
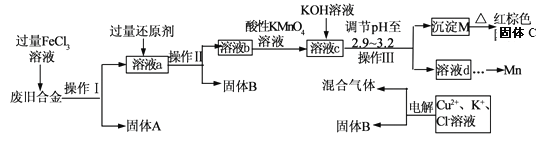
【題目】某化學興趣小組對一種廢舊合金(含有Cu、Fe、Si等元素)進行分離、回收再利用,所設計工藝流程如下。
已知:298K時,Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cu(OH)2]=2.2×10一20,
Ksp[Mn(OH)2]=1.9×10—13
回答下列問題:
(1)操作I、Ⅱ、Ⅲ為________,固體B為_________ (填化學式)。
(2)加人過量FeCl3溶液過程中與較不活潑的金屬反應的離子方程式__________________。
(3)調節pH至2.9~3.2的目的是分離_________ (填離子符號)
(4)①向溶液b中加入酸性KMnO4溶液發生反應的離子方程式為_________________。
②若用 a mol/LKMnO4溶液處理溶液b,當恰好反應時消耗KMnO4溶液V mL,所得紅棕色固體C的物質的量為_________(用含a、v的代數式表示)
(5)常溫下,若溶液c中所含的金屬陽離子濃度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀為_________ (填化學式)。
(6)用惰性電極電解時陽極產生標準狀況下的氣體6.72L,陰極得到的電子數為0.8NA,則生成氧氣的物質的量為________ mol.
【答案】 過濾 Cu 2Fe3+ +Cu= 2Fe2++Cu2+ Fe3+ MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O 2.5aV×10-3mol Mn(OH)2 0.1
【解析】試題分析:由流程可知,合金經氯化鐵溶液溶解后把其中的鐵和銅溶解,過濾后除去硅;向濾液中加入過量的銅,把過量的Fe3+還原,過濾得到銅,再向濾液中加入酸性高錳酸鉀溶液把亞鐵離子完全氧化為+3價鐵離子,然后再加堿調節pH使+3價鐵離子轉化為氫氧化鐵沉淀;濾液經處理后電解,陽極得到氯氣和氧氣、陰極得到銅。
(1)操作I、Ⅱ、Ⅲ為過濾,固體B為Cu。
(2) FeCl3溶液與較不活潑的金屬銅反應的離子方程式為2Fe3+ +Cu= 2Fe2++Cu2+。
(3)調節pH至2.9~3.2的目的是分離Fe3+。
(4)①向溶液b中加入酸性KMnO4溶液發生反應的離子方程式為MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O。
②若用 a mol/LKMnO4溶液處理溶液b,當恰好反應時消耗KMnO4溶液V mL,由反應的離子方程式可知,n(Fe3+)=5n(KMnO4)=5![]() V
V ![]() =5aV
=5aV ![]() ,所得紅棕色固體C為Fe2O3,其物質的量為2.5aV×10-3mol 。
,所得紅棕色固體C為Fe2O3,其物質的量為2.5aV×10-3mol 。
(5)常溫下,溶液c中所含的金屬陽離子為Fe3+、Cu2+和Mn2+,若三者濃度相等,向溶液c中逐滴加入KOH溶液,因為Ksp[Fe(OH)3] ![]() Ksp[Cu(OH)2]
Ksp[Cu(OH)2] ![]() Ksp[Mn(OH)2],所以先生成的沉淀是Fe(OH)3(由流程可知,pH=3.2時,Fe3+沉淀完全,而Cu2+和Mn2+尚未開始沉淀),最后生成的沉淀為Mn(OH)2。
Ksp[Mn(OH)2],所以先生成的沉淀是Fe(OH)3(由流程可知,pH=3.2時,Fe3+沉淀完全,而Cu2+和Mn2+尚未開始沉淀),最后生成的沉淀為Mn(OH)2。
(6)用惰性電極電解時陽極產生標準狀況下的氣體6.72L,陰極得到的電子數為0.8NA,由電子轉移守恒得,4n(O2)+2[![]() ]=0.8mol,則生成氧氣的物質的量為0.1mol.
]=0.8mol,則生成氧氣的物質的量為0.1mol.


 新編小學單元自測題系列答案
新編小學單元自測題系列答案科目:高中化學 來源: 題型:
【題目】下列有關物質用途的說法合理的是( )
A. Si可用于制造太陽能電池
B. 液氨可用作制冷劑
C. 聚氯乙烯可用于制食品包裝袋
D. 漂白粉可用于殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,有甲、乙兩份體積均為1L、濃度均為0.1mol·L-1的醋酸溶液,其pH為3,①甲用蒸餾水稀釋到100L時,溶液的pH變為x;②乙與等體積、濃度為0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。x、y的正確答案組合為
A. 3<x<5、0.2 B. 3<x<5、0.1 C. 3、0.1 D. 5、0.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25℃、101kPa時,一些物質的燃燒熱為,回答下列問題:
化學式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)寫出該條件下CH3OH(l)完全燃燒的熱化學方程式:_____________________________。
(2)根據蓋斯定律完成下列反應的熱化學方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工業上利用水煤氣合成甲醇的主要反應可表示為![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容積為1L的密閉容器中加入0.10molH2和0.05molCO,在一定溫度下發生上述反應,10min后反應達到平衡狀態,測得放出熱量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容積為1L的密閉容器中加入0.10molH2和0.05molCO,在一定溫度下發生上述反應,10min后反應達到平衡狀態,測得放出熱量3.632kJ。
①相同溫度條件下,上述反應的化學平衡常數K=___________。
②若容器容積不變,下列措施可增加CH3OH產率的是___________ (填標號)。
a.升高溫度
b.將CH3OH(g)從體系中分離
c.充入He,使體系總壓強增大
d.再充入0.10molH2和0.05molCO
e.加入催化劑
③反應達到平衡后,保持其他條件不變,若只把容器的體積縮小一半,平衡將___________(填“逆向”“正向”或“不”)移動,化學平衡常數K___________(填“增大”“減小”或“不變”)。
④溫度、容積相同的甲、乙兩個密閉容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反應達到平衡時甲放出的熱量為Q1kJ,乙吸收的熱量為Q2kJ,甲中CO的轉化率為a1,乙中CH3OH的轉化率為a2,則Q1+Q2=___________,a1+a2=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在三個體積均為2.0L的恒容密閉容器中分別加入一定量的X,發生反應:pX(g) ![]() Y(g)+Z(g),相關數據如下表所示:
Y(g)+Z(g),相關數據如下表所示:
容器編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列問題:
(1)若容器Ⅰ中反應經10min達到平衡,則前10min內Y的平均反應速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始時X的反應速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知該正反應為放熱反應,則T___________387(填“大于”或“小于”),判斷理由是___________。
(3)反應方程式中X的化學計量數p的取值為___________,容器Ⅱ中X的平衡轉化率為___________。若起始時向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,則反應將向___________ (填“正”或“逆”)反應方向進行,判斷理由是_____________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)為了檢驗和除去下表中的各種雜質(括號里的為雜質),請從①中選出適當的檢驗試劑,從②中選出適當的除雜試劑,將所選的答案用字母填入相應的空格內。
物質 | 檢驗試劑 | 除雜試劑 |
(Ⅰ)甲烷(乙烯 ) | __________ | __________ |
(Ⅱ)酒精(水) | __________ | __________ |
①檢驗試劑:A.無水硫酸銅 B.酸性高錳酸鉀溶液 C.水 D.氫氧化鈉溶液
②除雜試劑:a.無水硫酸銅 b.乙酸c.新制的生石灰 d.溴水
除雜時,乙烯發生反應的化學方程式為______________________________________。
(2)如圖,在左側試管中先加入2 mL 95%的乙醇,并在搖動下緩緩加入3 mL濃硫酸,再加入2 mL乙酸,充分搖勻。按圖連接好裝置,用酒精燈對左側試管小火加熱3~5 min后,改用大火加熱,當觀察到右側試管中有明顯現象時停止實驗。

試回答:在右側試管中通常加入________溶液,實驗生成的乙酸乙酯的密度比水________,是有特殊香味的液體。分離右側試管中所得乙酸乙酯的操作為________(只填名稱)。反應中濃硫酸的作用是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物A(C9H12O)可用于醫藥及香料的合成,A有如下轉化關系:

已知信息:
①A不能使酸性高錳酸鉀溶液褪色;
② ;
;
③![]()
回答下列向題:
(1)B→D與H→I的反應類型分別為:_________、_________。
(2)K所含官能閉的名稱為___________,B的結構簡式為____________。
(3)由E生成F的反應方程式為___________________________。
(4)J為一種具有3個六元環的酯,則其結構簡式為_________________。
(5)F的同分異構體中,能與NaHCO3反應生成CO2,且核磁共振氫譜為4組峰,且峰面積比為6:2:1:1的結構有_________種。
(6)糖叉丙酮(![]() )是一種重要的醫藥中間體,請參考上述合成路線,設計一條由叔丁基氯[(CH3)3CCl]和糠醛(
)是一種重要的醫藥中間體,請參考上述合成路線,設計一條由叔丁基氯[(CH3)3CCl]和糠醛(  )為原料制備糖叉丙酮的合成路線(無機試劑任用) _______。合成流程圖示例如下:
)為原料制備糖叉丙酮的合成路線(無機試劑任用) _______。合成流程圖示例如下:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下能實現的是( )
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③飽和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl3(aq)
FeCl3(aq)![]() 無水FeCl3
無水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ②③④ B. ①③⑤ C. ②④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己知A、B、C、D、E五種元素是元素周期表中前四周期元素,且原子序數依次增大,其中A、B、C為同周期的非金屬元素,且B、C原子中均有兩個未成對電子。 D、E 為同周期元素且分別位于s區和d區。五種元素所有的s能級電子均為全充滿。E的d能級電子數比A、B、C最高能層的P能級電子數之和少一個。回答下列問題:
(1)五種元素中,電負性最大的是___________________(填元素符號)。
(2)E常有+2、+3兩種價態,寫出E2+的最外層電子排布式________________________。
(3)自然界中,含A的鈉鹽是一種天然礦藏,其化學式寫作Na2A4O7·10H2O,實際上它的結構單元是由兩個H3AO3和兩個[A(OH)4]-縮合而成的雙六元環,應該寫成Na2A4O5(OH)4·8H2O,其結構如圖1。①A原子的雜化軌道類型為_______________________________。
②該陰離子由極性鍵和配位鍵構成,請在圖1中用“→”標出其中的配位鍵____________。
③已知H3AO3為一元弱酸,根據上述信息,用離子方程式解釋分析H3AO3為一元酸的原因(用元素符號表示)____________________________________。
(4)①寫出ECl3與苯酚(C6H5OH)反應生成[E(OC6H5)6]3-的化學方程式:________________________。
②請從分子結構的角度解釋苯酚室溫下在水中的溶解度小,當溫度高于65℃時,能與水混溶:_______________________________________________________。
(5)由元素B、D組成的某離子化合物的晶胞結構如圖2,寫出該物質的電子式_____________________,若晶胞的長、寬、高分別為520pm、520pm和690pm,該晶體密度為______________g/cm3(保留到小數點后兩位)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com