
【題目】阿伏加德羅常數約為NA。下列敘述中正確的是 ( )
A. I L 0.1mol/L的FeCl3溶液中,H+的數目約為0.1NA
B. 1 mol金剛石中含有C-C鍵的數目為2NA
C. 7.8 g Na2O2中含有的陰離子數目約為0.2NA
D. 標準狀況下,l L甲醇完全燃燒后生成的CO2分子個數約為(1/22.4)NA
【答案】B
【解析】
A.1L0.1mol/L的FeCl3溶液中n(FeCl3)=1L×0.1mol/L=0.1mol,Fe3+能發生一定程度的水解,但產生的H+的物質的量小于0.1mol,數目小于0.1NA,故A錯誤;B.金剛石晶體中每個C原子成4個C-C,故1個C-C鍵為2個C原子共用,故1mol金剛石含有2molC-C鍵,1mol金剛石中含有C-C鍵的數目為2NA,故C正確;C. 7.8g過氧化鈉的物質的量為![]() ,Na2O2中含有的陰離子為O22-,O22-的物質的量為0.1mol,故含有含有的陰離子數目約為0.1NA,故C錯誤;D.甲醇是液體,不能利用氣體摩爾體積22.4L/mol,1L甲醇的物質的量遠遠大于(1/22.4)NA,故D錯誤;本題選B。
,Na2O2中含有的陰離子為O22-,O22-的物質的量為0.1mol,故含有含有的陰離子數目約為0.1NA,故C錯誤;D.甲醇是液體,不能利用氣體摩爾體積22.4L/mol,1L甲醇的物質的量遠遠大于(1/22.4)NA,故D錯誤;本題選B。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:
【題目】鉻元素及其化合物在生產、生活中具有廣泛的用途。以某鉻礦石(主要成分是Cr2O3,含Fe2O3、SiO2等雜質)為原料生產Cr2O3的流程如下:
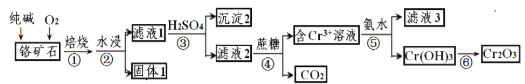
已知:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,焙燒時SiO2也參與反應。
4Na2CrO4+4CO2,焙燒時SiO2也參與反應。
(1)Cr(OH)3和Al(OH)3性質類似,則Cr(OH)3與KOH反應的離子方程式為_________________;
(2)沉淀2的化學式為__________;
(3)步驟③中CrO42-轉化成Cr2O72- ,寫出其離子方程式____________________,硫酸能否換成鹽酸并說明其理由___________________;
(4)濾液3中的主要溶質是兩種鹽,其化學式為__________________________;
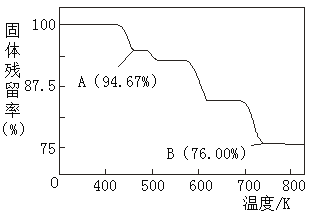
(5)CrO3的熱穩定性較差,加熱時逐步分解,其固體殘留率隨溫度的變化如圖所示,則B點時鉻的氧化物化學式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把0.6molW氣體和0.5molX氣體混合于2L密閉容器中,使它們發生如下反應:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若測知以Z的濃度變化表示的反應速率為0.0025mol/(L·s),試計算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若測知以Z的濃度變化表示的反應速率為0.0025mol/(L·s),試計算
(1)前2min內用W的濃度變化表示的平均反應速率為_______________。
(2)2min末時X的濃度為_____________________________。
(3)化學反應方程式中n=_____________________________。
(4)2min末,恢復到反應前溫度,體系內壓強是反應前壓強的__________倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學將一定濃度NaHCO3溶液加入到CuSO4溶液中發現生成了沉淀。甲同學認為沉淀是CuCO3;乙同學認為沉淀是CuCO3和Cu(OH)2的混合物,他們設計實驗測定沉淀中CuCO3的質量分數。
(1)按照甲同學的觀點,發生反應的離子方程式為_____________________。
(2)兩同學利用下圖所示裝置進行測定:

①在研究沉淀物組成前,須將沉淀從溶液中分離并凈化。具體操作依次為過濾、洗滌、干燥。
②裝置E中堿石灰的作用是__________________。
③實驗過程中有以下操作步驟:
a.關閉K1、K3,打開K2、K4,充分反應
b.打開K1、K4,關閉K2、K3,通入過量空氣
c.打開K1、K3,關閉K2、K4,通入過量空氣
正確的順序是____(填選項序號,下同)。若未進行步驟____,將使測量結果偏低。
④若沉淀樣品質量為m g,裝置D質量增加了n g,則沉淀中CuCO3的質量分數為____。
(3)丙同學認為還可以通過測量CO2的體積并測量____來測定沉淀中CuCO3的質量分數。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】要證明某溶液中不含Fe3+而可能含有Fe2+進行如下實驗操作時最佳順序為
①加入足量氯水 ②加入足量KMnO4溶液③ 加入少量KSCN溶液
A.①②B.③②C.③①D.①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.2 mol·L-1NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根據這兩種溶液的配制情況回答下列問題:
(1)如圖所示的儀器中配制溶液肯定不需要的是________(填序號),配制上述溶液還需用到的玻璃儀器是________(填儀器名稱)。

(2)下列有關容量瓶使用方法的操作中,錯誤的是_______。
A.使用容量瓶之前應檢查它是否漏水
B.容量瓶用蒸餾水洗凈后,再用待配溶液潤洗
C.定容時,將蒸餾水小心倒入容量瓶中直至與刻度線齊平
D.配制溶液時,如果試樣是液體,用量筒量取試樣后直接倒入容量瓶中定容
E.蓋好瓶塞,用食指頂住瓶塞,另一只手托住瓶底,把容量瓶反復上下顛倒,搖勻
(3)在配制NaOH溶液時:
①根據計算用托盤天平稱取NaOH的質量為________g;
②若NaOH溶液在轉移至容量瓶時,灑落了少許,則所得溶液濃度________(填“>”“<”或“=”)0.2 mol·L-1;
③若NaOH固體溶解后立即移入容量瓶→洗燒杯→洗滌液移入容量瓶→定容,則所得溶液濃度________(填“>”“<”或“=”)0.2 mol·L-1。
(4)在配制硫酸溶液時:
①所需質量分數為98%、密度為1.84 g·cm-3的濃硫酸的體積為________(計算結果保留一位小數)mL;
②如果實驗室有15 mL、20 mL、50 mL量筒,應選用______mL量筒最好;
③配制過程中需先在燒杯中將濃硫酸進行稀釋,稀釋時操作方法是___________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是
A. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4、SO42
B. ![]() =1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 與Al反應能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. ![]() =1×10 12的溶液中:K+、Na +、CO32-、NO3-
=1×10 12的溶液中:K+、Na +、CO32-、NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚異戊二烯橡膠( )具有與天然橡膠相似的化學組成、立體結構和力學性能,具有良好的強度、黏性和彈性等,其合成路線如下圖:
)具有與天然橡膠相似的化學組成、立體結構和力學性能,具有良好的強度、黏性和彈性等,其合成路線如下圖:

已知:
① ;
;
②同一碳原子上有兩個碳碳雙鍵時分子不穩定。
(1)A既能使酸性KMnO4溶液褪色,也能使溴的四氯化碳溶液褪色,則A的化學名稱是__________,該物質中含有的官能團名稱是______________。
(2)![]() 和氧氣作反應物,溫度為110℃時除生成B外,還生成一種副產物F,其分子式為C6H6O,該物質的水溶液遇FeCl3溶液顯紫色,那么物質F不可能發生的反應類型是_________。
和氧氣作反應物,溫度為110℃時除生成B外,還生成一種副產物F,其分子式為C6H6O,該物質的水溶液遇FeCl3溶液顯紫色,那么物質F不可能發生的反應類型是_________。
a.加成反應 b.取代反應 c.消去反應 d.縮聚反應
(3)寫出合成路線圖中有機化合物C的結構簡式___________________。
(4)寫出D生成E的化學反應方程式_____________。
(5)D的同分異構體中能發生銀鏡反應的共有______種,其中核磁共振氫譜有五種不同化學環境的氫,且峰面積比為3:3:2:1:1是______________(寫結構簡式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com