
【題目】要證明某溶液中不含Fe3+而可能含有Fe2+進行如下實驗操作時最佳順序為
①加入足量氯水 ②加入足量KMnO4溶液③ 加入少量KSCN溶液
A.①②B.③②C.③①D.①②③
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是無色、有強還原性的液體,實驗室制備水合肼的原理為:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。據此,某學生設計了下列實驗。
I、制備 NaClO溶液
實驗裝置如下圖圖甲所示(部分夾持裝置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
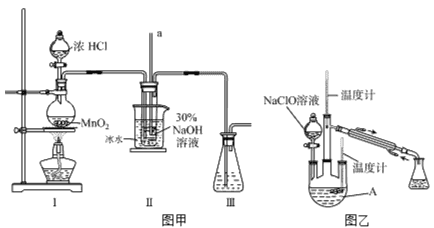
(1)配制30%NaOH溶液時,所需玻璃儀器除量筒外還有______________(填字母)。
A.容量瓶 B.燒杯 C.移液管 D.玻璃棒
(2)裝置I中發生的離子反應方程式是_____________________________。
Ⅱ、制取水合肼
實驗裝置如上圖圖乙所示
(3)反應過程中,如果分液漏斗中溶液的滴速過快,部分N2H4·H2O參與A中反應并產生大量氮氣,產品產率因此降低,請寫出降低產率的相關化學反應方程式________________________________;充分反應后,加熱蒸餾A內的溶液即可得到水合肼的粗產品。
(4)稱取餾分0.3000g,加水配成20.0mL溶液,一定條件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定時,可以選用的指示劑為____________________;
②實驗測得消耗I2溶液的平均值為20.00L,餾分中N2H4·H2O的質量分數為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容中加入2.0 mol SO2和1.0 mol O2,一定條件下發生如下反應2SO2+O2![]() 2SO3。反應達到平衡后,各物質的物質的量可能為( )
2SO3。反應達到平衡后,各物質的物質的量可能為( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 0.20 | 0.10 | 1.80 |
C | 1.0 | 0.8 | 1.0 |
D | 0 | 0 | 2.0 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法不正確的是

A. 水合銅離子的模型如圖1所示,1個水合銅離子中有4個配位鍵
B. CaF2晶體的晶胞如圖2所示,每個CaF2晶胞平均占有4個Ca2+
C. H原子的電子云圖如圖3所示,H原子核外大多數電子在原子核附近運動
D. 金屬銅中Cu原子堆積模型如圖4為最密堆積每個Cu原子的配位數均為12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. NO2、SO2、BF3、NCl3分子中沒有一個分子中原子的最外層電子都滿足了8e-穩定結構;
B. P4和CH4都是正四面體分子且鍵角都為109o28ˊ;
C. CO2、SO2都是直線形的分子
D. CH2=CH2分子中共有五個σ鍵和一個π鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏加德羅常數約為NA。下列敘述中正確的是 ( )
A. I L 0.1mol/L的FeCl3溶液中,H+的數目約為0.1NA
B. 1 mol金剛石中含有C-C鍵的數目為2NA
C. 7.8 g Na2O2中含有的陰離子數目約為0.2NA
D. 標準狀況下,l L甲醇完全燃燒后生成的CO2分子個數約為(1/22.4)NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于膠體的敘述不正確的是( )
A. 溶液和膠體的本質區別是否有丁達爾效應
B. 向氫氧化鐵膠體中緩緩滴加稀硫酸,先產生沉淀,進而沉淀溶解
C. 用半透膜滲析的方法,可以分離膠體和溶液
D. 水泥廠、面粉廠通常利用膠體電泳進行高壓靜電除塵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】密閉容器中進行如下反應:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始濃度分別是0.2mo1/L、0.6mol/L、0.4mol/L,當達到平衡時,下列數據可能正確的是
2Z(g),X、Y、Z起始濃度分別是0.2mo1/L、0.6mol/L、0.4mol/L,當達到平衡時,下列數據可能正確的是
A. X為0.25mol/L,Z為0.5mol/L B. Y為1.2mo1/L
C. X為0.3mol/L,Z為0.3mol/L D. Z為0.6mo1/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E 分別代表中學化學中的常見物質,請根據題目要求回答下列問題:
(1)實驗室常用A的飽和溶液制備微粒直徑為1nm~l00nm的紅褐色液相分散系。則該反應的化學方程式為____________________________。
(2)B為地殼中含量最高的金屬元素的氯化物,向50.0mL6mol/L的B溶液中逐滴滴入100mL某濃度的KOH溶液,若產生7.8g白色沉淀,則加入的KOH溶液的濃度可能為________________。
(3)將A、B中兩種金屬元素的單質用導線連接,插入一個盛有KOH溶液的燒杯中構成原電池,則電池反應為_______________________。
(4)C、D、E均是短周期中同一周期元素形成的單質或化合物,常溫下D為固體單質,C和E均為氣態化合物,且可發生反應:C+D![]() E。將一定量的氣體C通入某濃度的KOH溶液得溶液F,向F溶液中逐滴滴入稀鹽酸,加入n(HCl)與生成n(C)的關系如圖所示,則生成F的離子方程式______________________。
E。將一定量的氣體C通入某濃度的KOH溶液得溶液F,向F溶液中逐滴滴入稀鹽酸,加入n(HCl)與生成n(C)的關系如圖所示,則生成F的離子方程式______________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com