
【題目】下列有關說法不正確的是

A. 水合銅離子的模型如圖1所示,1個水合銅離子中有4個配位鍵
B. CaF2晶體的晶胞如圖2所示,每個CaF2晶胞平均占有4個Ca2+
C. H原子的電子云圖如圖3所示,H原子核外大多數電子在原子核附近運動
D. 金屬銅中Cu原子堆積模型如圖4為最密堆積每個Cu原子的配位數均為12
【答案】C
【解析】分析:由圖1可知,水合銅離子中有4個水分子與銅離子形成配位鍵;由圖2可知,CaF2晶體的晶胞中有8個氟離子和4個鈣離子;由圖3 中H原子的電子云圖可知,電子在離核較近的區域出現的機會較多;由圖4可知,金屬銅中Cu原子堆積方式為最密堆積,每一層原子均為密置層,每個銅原子與同一層中6個原子緊密排列,另外還與上、下兩層各3個原子緊密排列,故其配位數為12.。
詳解:A. 水合銅離子的模型如圖1所示,1個水合銅離子中有4個配位鍵,A正確;
B. CaF2晶體的晶胞如圖2所示,每個CaF2晶胞平均占有4個Ca2+,B正確;
C. H原子的電子云圖如圖3所示,H原子核外只有一個電子,電子在離核較近的區域出現的機會較多,C不正確;
D. 金屬銅中Cu原子堆積模型如圖4為最密堆積,每個Cu原子的配位數均為12,D正確。
綜上所述,本題選C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】《本草衍義》中對精制砒霜過程有如下敘述:“取砒之法,將生砒就置火上,以器覆之,令砒煙上飛著覆器,遂凝結累然下垂如乳,尖長者為勝,平短者次之。”文中涉及的操作方法是( )
A. 蒸餾 B. 升華 C. 蒸發 D. 萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鎘(Ni—Cd)可充電電池在現代生活中有廣泛應用。已知某鎳鎘電池的電解質溶液為KOH溶液,其充、放電按下式進行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有關該電池的說法正確的是
Cd(OH)2 + 2Ni(OH)2。有關該電池的說法正確的是
A.充電時陽極反應:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充電過程是化學能轉化為電能的過程
C.放電時負極附近溶液的堿性不變
D.放電時電解質溶液中的OH-向正極移動
【答案】A
【解析】放電相當于原電池,充電相當于電解池。充電是把電能轉化為化學能,B不正確。放電時負極反應式為Cr-2e-+2OH-=Cr(OH)2,所以負極附近溶液的堿性減弱,C不正確。在原電池中陽離子向正極移動,陰離子向負極移動,D不正確。答案是A。
【題型】單選題
【結束】
26
【題目】根據所學知識完成題目:
(1)某課外活動小組同學用圖1裝置進行實驗,試回答下列問題:
①若開始時開關K與a連接,則鐵發生電化學腐蝕中的___腐蝕.請寫出正極反應式:___ .
②若開始時開關K與b連接時,兩極均有氣體產生,則N端是電源的___極(填正或負),則總反應的離子方程式為___ .
(2)該小組同學設想,用如圖2所示裝置電解硫酸鈉溶液來制取氫氣、氧氣、硫酸和氫氧化鈉.
①制得的氫氧化鈉溶液從出口(填“A”、“B”、“C”或“D”)___導出.通過陰離子交換膜的離子數___(填“>”、“<”或“=”)通過陽離子交換膜的離子數.
②通電開始后,陰極附近溶液pH會增大,請簡述原因:___ .
【答案】 吸氧 O2+4e﹣+2H2O=4OH﹣ 負 2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑ D < H+在陰極放電,水的電離平衡正向移動,溶液中OH﹣濃度增大,pH增大(合理即可)
2OH﹣+H2↑+Cl2↑ D < H+在陰極放電,水的電離平衡正向移動,溶液中OH﹣濃度增大,pH增大(合理即可)
【解析】(1)①若開始時開關K與a連接,該裝置構成原電池,發生電化學腐蝕中的吸氧腐蝕,正極上氧氣發生還原反應;②若開始時開關K與b連接時,兩極均有氣體產生,則Fe作陰極,石墨作陽極,陽極上氯離子放電、陰極上氫離子放電。
(2)①陰極上氫離子放電,則NaOH在陰極生成;根據陰陽離子的移動方向,通過相同電量時,陰陽離子交換的個數判斷;②水電離生成的氫離子放電,而氫氧根離子不放電。
(1)①開關K與a連接,為原電池,NaCl溶液為中性,發生吸氧腐蝕,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+2H2O=4OH-,故答案為:吸氧;O2+4e-+2H2O=4OH-;
②K與b連接,為電解池,若開始時開關K與b連接時,兩極均有氣體產生,則Fe作陰極,石墨作陽極,氯離子、氫離子放電,則N為電源負極,電解的總離子反應為2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,故答案為:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案為:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)①陰極上氫離子放電,則NaOH在陰極生成,由圖可知,D在陰極附近,制得的氫氧化鈉溶液從D出口導出;陽極氫氧根離子放電,因此硫酸根離子向陽極移動,陰極氫離子放電,因此鈉離子向陰極移動,所以通過相同電量時,通過陰離子交換膜的離子數小于通過陽離子交換膜的離子數,故答案為:D;<;
②水電離出的氫離子在陰極放電,而氫氧根離子不放電,促進水的電離,導致溶液中氫氧根離子濃度增大,溶液的pH增大,故答案為:H+在陰極放電,水的電離平衡正向移動,溶液中OH-濃度增大,pH增大(合理即可)。
【題型】綜合題
【結束】
27
【題目】在某一容積為5L的密閉容器內,加入 0.2mol的CO和0.2mol的H2O,在催化劑存在和800℃的條件下加熱,發生如下反應:CO(g)+H2O(g)CO2(g)+H2(g);△H>0反應中CO2的濃度隨時間變化情況如下圖:

(1)根據上圖數據,反應開始至達到平衡時,CO2的化學反應速率為v(CO2)=___mol/(Lmin);反應達平衡時,c(H2O)=___ mol/L,該溫度下的平衡常數K=___ .
(2)判斷該反應達到平衡的依據是___ .
①正、逆反應速率都為零
②CO減少的化學反應速率和CO2減少的化學反應速率相等
③CO、H2O、CO2、H2的濃度都相等
④CO、H2O、CO2、H2的濃度都不再發生變化
(3)如要一開始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,在相同的條件下,反應達平衡時,c(H2)=___mol/L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有可逆反應:![]() ,下列各條件的敘述中,能表明反應已達,平衡狀態的是( )
,下列各條件的敘述中,能表明反應已達,平衡狀態的是( )
A. 各物質的物質的量濃度比為2:1:1
B. 壓強保持不變的狀態
C. 斷裂2 mol H-I鍵的同時生成1 mol I-I鍵
D. 混合物中各組成成分的含量不再改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積固定的2L密閉容器中,一定條件下發生如下反應:X(g)+2Y(g)nZ(g),反應過程中各物質的量與時間的關系如圖所示.完成下列填空:
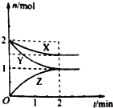
(1)n=______;
(2)Y的平衡濃度為_______;
(3)反應開始至平衡,X 的反應速率v(X)=______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)從樟科植物枝葉提取的精油中含有下列甲、乙、丙三種成分:

丙
分子式 | C16H14O2 |
部分性質 | 能使Br2/CCl4褪色 |
能在稀H2SO4中水解 |
(1)甲中含氧官能團的名稱為________。
(2)由甲轉化為乙需經下列過程(已略去各步反應的無關產物,下同):

其中反應Ⅰ的反應類型為________,反應Ⅱ的化學方程式為_______________(注明反應條件)。
(3)已知:RCH===CHR′![]() RCHO+R′CHO;2HCHO
RCHO+R′CHO;2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一種合成路線圖如下(A~F均為有機物,圖中Mr表示相對分子質量):

①下列物質不能與C反應的是________(選填序號)。
a.金屬鈉 b.HBr c.Na2CO3溶液 d.乙酸
②寫出F的結構簡式__________________________________。
③丙有多種同分異構體,寫出能同時滿足下列條件的同分異構體________。
a.苯環上連接三種不同官能團
b.能發生銀鏡反應
c.能與Br2/CCl4發生加成反應
d.遇FeCl3溶液顯示特征顏色
④綜上分析,丙的結構簡式為____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關金屬的工業制法中,正確的是
A. 以海水為原料制得精鹽,再電解精鹽的水溶液制取鈉
B. 用海水、石灰乳等為原料,經一系列過程制得氧化鎂,用H2還原氧化鎂制得鎂
C. 以鐵礦石、焦炭、空氣、石灰石等為原料,通過反應產生的CO在高溫下還原鐵礦石制得鐵
D. 從鋁土礦中獲得氧化鋁再制得氯化鋁固體,電解熔融的氯化鋁得到鋁
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com