
(15分)海洋是一座巨大的寶藏,海水中蘊含80多種元素。氯堿工業和制備金屬鎂的原料都可來自于海水。
Ⅰ.在氯堿工業中,曾用石棉隔膜電解槽來電解食鹽水(如圖甲所示)。
(1)寫出陽極的反應式 。
(2)圖甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.隨著科技的發展,電解工藝不斷革新,電解效率和產品純度得到提高。20世紀80年代起,隔膜法電解工藝逐漸被離子交換膜電解技術取代。
(1)離子交換膜電解槽(如圖乙所示)中⑥、⑦分別是_______、______________。
(2)已知一個電子的電量是1.602×10-19C,用離子膜電解槽電解飽和食鹽水,當電路中通過1.929×105 C的電量時,生成NaOH_ g。
Ⅲ.下圖是工業上生產鎂的流程。
(1)寫出下列反應的化學方程式:
①沉淀池: ; ②電解: ;
(2)整個生產流程中循環使用的物質是 。
(3)簡述加熱氯化鎂的結晶水合物使之脫水轉化為無水氯化鎂的注意事項: 。
科目:高中化學 來源: 題型:填空題
鋼鐵很容易生銹而被腐蝕,每年因腐蝕而損失的鋼材占世界鋼鐵年產量的四分之一。
(1)為了降低某水庫的鐵閘門被腐蝕的速率,可以采用圖甲所示的方案,其中焊接在鐵閘門上的固體材料R可以采用________(填字母)。
| A.銅 | B.鈉 |
| C.鋅 | D.石墨 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以黃銅礦精礦為原料,制取硫酸銅及金屬銅的工藝如下所示:
Ⅰ.將黃銅礦精礦(主要成分為CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下裝置進行電化學浸出實驗
將精選黃銅礦粉加入電解槽陽極區,恒速攪拌,使礦粉溶解。在陰極區通入氧氣,并加入少量催化劑。
Ⅲ.一段時間后,抽取陰極區溶液,向其中加入有機萃取劑(RH)發生反應:
2RH(有機相)+ Cu2+(水相) R2Cu(有機相)+ 2H+(水相)
R2Cu(有機相)+ 2H+(水相)
分離出有機相,向其中加入一定濃度的硫酸,使Cu2+得以再生。
Ⅳ.電解硫酸銅溶液制得金屬銅。
(1)黃銅礦粉加入陽極區與硫酸及硫酸鐵主要發生以下反應:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 陽極區硫酸鐵的主要作用是 。
② 電解過程中,陽極區Fe3+的濃度基本保持不變,原因是 。
(2)陰極區,電極上開始時有大量氣泡產生,后有固體析出,一段時間后固體溶解。寫出上述現象對應的反應式 。
(3)若在實驗室進行步驟Ⅲ,分離有機相和水相的主要實驗儀器是 ;加入有機萃取劑的目的是 。
(4)步驟Ⅲ,向有機相中加入一定濃度的硫酸,Cu2+得以再生的原理是 。
(5)步驟Ⅳ,若電解200mL0.5 mol/L的CuSO4溶液,生成銅3.2 g,此時溶液中離子濃度由大到小的順序是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C三個燒杯中分別盛有相同物質的量濃度的稀硫酸。
(1) A中反應的離子方程式為 。
(2)B中Sn極的電極反應式為 。Sn極附近溶液的c (填 “變大”“變小”或“不變”)。
(填 “變大”“變小”或“不變”)。
(3)C中被腐蝕的金屬是 ,總反應的化學方程式為
,比較A、B、C中鐵被腐蝕的速率,由快到慢的順序為 (填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)
對工業廢水和生活污水進行處理是防止水體污染、改善水質的主要措施。
(1)含氰廢水中的CN-有劇毒。
①CN-中C元素顯+2價, N元素顯-3價,用原子結構解釋N元素顯負價的原因是 ,共用電子對偏向N原子,N元素顯負價。
②在微生物的作用下,CN-能夠被氧氣氧化成HCO3-,同時生成NH3,該反應的離子方程式為 。
(2)含乙酸鈉和對氯酚( )的廢水可以利用微生物電池除去,其原理如下圖所示。
)的廢水可以利用微生物電池除去,其原理如下圖所示。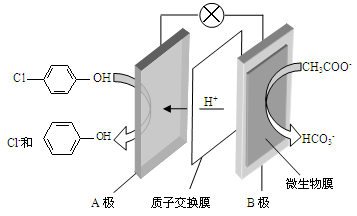
①B是電池的 極(填“正”或“負”);②A極的電極反應式為 。
(3)電滲析法處理廚房垃圾發酵液,同時得到乳酸的原理如下圖所示(圖中“HA”表示乳酸分子,A- 表示乳酸根離子)。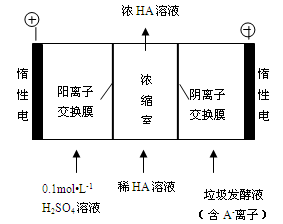
①陽極的電極反應式為 。
②簡述濃縮室中得到濃乳酸的原理: 。
③ 電解過程中,采取一定的措施可控制陽極室的pH約為6-8,此時進入濃縮室的OH-可忽略不計。400mL 10 g?L-1乳酸溶液通電一段時間后,濃度上升為145 g?L-1(溶液體積變化忽略不計),陰極上產生的H2在標準狀況下的體積約為 L。(乳酸的摩爾質量為90 g? mol-1)
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
Ⅰ:某課外活動小組用如圖裝置進行實驗,試回答下列問題。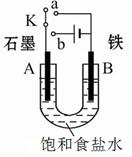
(1)若開始時開關K與a連接,則B極的電極反應式為 。
(2)若開始時開關K與b連接,則B極的電極反應式為
Ⅱ:下圖A、B、C三個燒杯中分別盛有相同物質的量濃度的稀硫酸。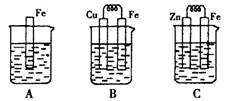
(3)B中若收集到224ml氣體(標準狀況),則溶解的金屬質量為
(4)C中被腐蝕的金屬是__________(填化學式),A、B、C中鐵被腐蝕的速率,由快到慢的是順序是_____________(用“>”表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(15分)為了減少煤燃燒對大氣造成的污染,煤的氣化和液化是高效、清潔利用煤炭的重要途徑,而減少CO2氣體的排放也是人類面臨的重大課題。煤綜合利用的一種途徑如下所示:
(1)用如圖[(1)小題圖]所示裝置定量檢測過程①產生的CO2(已知:煤粉燃燒過程中會產生SO2)B中預期的實驗現象是 ,D中的試劑是 。

(2)已知① C(s) + H2O(g) = CO(g) + H2 (g) ; ΔH1 =" +131.3" kJ·mol-1
② C(s) + 2H2O(g) = CO2(g) + 2H2(g) ;ΔH2 =" +90" kJ·mol-1
則一氧化碳與水蒸氣反應生成二氧化碳和氫氣的熱化學方程式是 。
(3)用(3)小題圖裝置可以完成⑤的轉化,同時提高能量的利用率。其實現的能量轉化形式主要是由 能轉化為 能,a的電極反應式是 。
(4)燃煤煙氣中的CO2可用稀氨水吸收,不僅可以減少CO2的排放,也可以生產化肥碳酸氫銨。假設該方 法每小時處理含CO2的體積分數為11.2%的燃煤煙氣 1000 m3(標準狀況),其中CO2的脫除效率為80%,則理論上每小時生產碳酸氫銨 kg。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com