
【題目】![]() 和
和![]() 在溶液中有:2
在溶液中有:2![]() (黃)+2H+
(黃)+2H+![]()
![]() (橙)+H2O的轉化。室溫下初始濃度為1.0 mol/L的Na2CrO4溶液中c(
(橙)+H2O的轉化。室溫下初始濃度為1.0 mol/L的Na2CrO4溶液中c(![]() )隨c(H+)的變化如圖所示。不正確的是( )
)隨c(H+)的變化如圖所示。不正確的是( )

A. 向Na2Cr2O7溶液中加NaOH固體,溶液的顏色為黃色
B. 由圖可知,溶液酸性增大,![]() 的平衡轉化率增大
的平衡轉化率增大
C. 根據A點數據計算出該轉化反應的平衡常數為1 (mol·L-1)-3
D. 溫度升高,溶液中![]() 的平衡轉化率減小,則該反應為放熱反應
的平衡轉化率減小,則該反應為放熱反應
【答案】C
【解析】A. 向Na2Cr2O7溶液中加NaOH固體中和氫離子,氫離子濃度降低,平衡向逆反應方向進行,溶液的顏色為黃色,A正確;B. 溶液酸性增大,平衡2CrO42-+2H+Cr2O72-+H2O正向進行,CrO42-的平衡轉化率增大,B正確;C. A點Cr2O72-的濃度為0.25mol/L,則消耗的CrO42-的濃度為0.5mol/L,則溶液中c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+濃度為1×10-7mol/L,此時該轉化反應的平衡常數為K=![]() =1.0×1014,C錯誤;D. 升高溫度,溶液中CrO42-的平衡轉化率減小,平衡逆向移動,說明正反應是放熱反應,D正確,答案選C。
=1.0×1014,C錯誤;D. 升高溫度,溶液中CrO42-的平衡轉化率減小,平衡逆向移動,說明正反應是放熱反應,D正確,答案選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在一定條件下,1mol N2和3mol H2混合后反應,達到平衡時測得混合氣體的密度是同溫同壓下氫氣的5倍,則氮氣的轉化率為( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄酒常用焦亞硫酸鈉(Na2S2O5)作抗氧化劑。某興趣小組用下圖裝置(夾持裝置略)測定某葡萄酒中抗氧化劑的殘留量(以游離的SO 2計算),方案如下:向B中加入300.00mL葡萄酒和適量的稀硫酸,加熱使SO2全部逸出并與C中H2O2完全反應,除去C中過量的H2O2后,將C中液體轉移至小燒杯中,向燒杯內逐滴加入BaCl2溶液至沉淀量不再增加,過濾出沉淀,經洗滌、干燥后,稱得固體的質量為0.2796g,則該葡萄酒中SO2的含量為
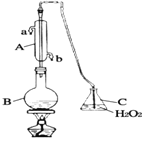
A. 0.256 g/L B. 0.04 g/L C. 0.24 g/L D. 0.0768 g/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物是大氣污染物之一,用活性炭或一氧化碳還原氮氧化物,可防止空氣污染。回答下列問題:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反應的平衡常數表達式為K=![]() ,請寫出此反應的熱化學方程式:_______;下列措施能夠增大此反應中NO的轉化率的是(填字母代號)_________。
,請寫出此反應的熱化學方程式:_______;下列措施能夠增大此反應中NO的轉化率的是(填字母代號)_________。
a.增大容器壓強 b.升高溫度 c.使用優質催化劑 d.增大CO的濃度
(2)向容積為2L的密閉容器中加入活性炭(足量)和NO,發生反應C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物質的量變化如下表所示。
N2(g)+CO2(g),NO和N2的物質的量變化如下表所示。
物質的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min內,以CO2表示的該反應速率v(CO2)=______,該條件下的平衡常數K=________。
②第15 min后,溫度調整到T2,數據變化如上表所示,則T1_______ T2(填“>”“<”或“=”)。
③若30min時,保持T2不變,向該容器中再加入該四種反應混合物各2 mol,則此時反應_______移動(填“正向”“逆向”或“不”);最終達平衡時NO的轉化率a=______________。
(3)在25 ℃下,向濃度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____沉淀(填化學式),當兩種沉淀共存時,溶液中c(Mg2+)/c(Cu2+)=__________(已知25 ℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的工業原料。
(1)實驗室可用高錳酸鉀和濃鹽酸反應制取氯氣,反應的化學方程式是:__________。
(2)資料顯示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某學習小組利用此原理設計如圖所示裝置制取氯氣并探究其性質:
2CaSO4+2Cl2↑+2H2O。某學習小組利用此原理設計如圖所示裝置制取氯氣并探究其性質:

①在該實驗中,甲部分的裝置是__________(填字母)。
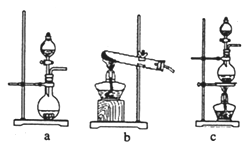
如何檢查該裝置的氣密性?__________________________________________。
②乙裝置中FeCl2溶液與Cl2:反應的離子方程式是_______________。
③丙裝置中通人少量Cl2,可制得某種生活中常用的漂白、消毒的物質。已知碳酸的酸性強于次氯酸,則丙中發生反應的化學方程式是____________。
④該實驗存在明顯的缺陷,改進的方法________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的離子,能在溶液中大量共存的是
A. K+、H+、SO![]() 、OH- B. Na+、Ca2+、CO
、OH- B. Na+、Ca2+、CO![]() 、NO
、NO![]()
C. Na+、H+、Cl-、CO![]() D. Na+、Cu2+、Cl-、SO
D. Na+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH減小,但又要使醋酸電離程度減少,應采取( )
A.加入少量CH3COONa固體 B.通入少量氯化氫氣體
C.升高溫度 D.加入少量氫氧化鈉固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G六種短周期主族元素,原子序數依次增大。其中B的單質在常溫下為雙原子分子,它與A的單質可形成分子X,X的水溶液呈堿性;A、D同主族,D的焰色反應為黃色;E的簡單陽離子與X具有相同電子數,且E是同周期中簡單離子半徑最小的元素;F元素的原子最外層比次外層少兩個電子,C、G兩種元素的原子最外層共有13個電子。則
(1)F在元素周期表中的位置為_______________。
(2)在2 L的密閉容器中,充入2 mol B2和3 mol A2,在一定條件下發生反應,5 s后測得A2為1.8 mol,則以B2的表示的反應速率v(B2)為__________________________。
(3)常溫下,液態的B2A4與氣態的BC2兩者發生反應生成無毒物質,16g B2A4發生反應放熱akJ,該反應的熱化學方程式為_______________。
(4)D2F溶液在空氣中長期放置發生反應,生成一種強堿與D2F2。D2F2與過氧化鈉的結構和化學性質相似,其溶液顯黃色。D2F2的電子式為_______,寫出D2F在空氣中長期放置生成D2F2的化學反應方程式為:_____________。D2F2的溶液與稀硫酸反應產生的現象為_____________。
(5)化學家發現一種化學式為A4B4的離子化合物,一定條件下1mol A4B4熔融電離生成兩種離子各1mol,則該物質熔融時的電離方程式為____________。
(6)向30mL某濃度由A、B、C、D中三種元素形成一元強堿溶液通入CO2氣體后得溶液M,因CO2通入量的不同,溶液M的組成也不同。若向M中逐滴加入0.1mol/L鹽酸,產生的氣體V(CO2)與加入鹽酸的體積V[HCl(aq)]的關系有下列圖示兩種情況(不計CO2的溶解)。

則曲線Y表明M中的溶質為________;原NaOH溶液的物質的量濃度為_______;由曲線X、Y可知,兩次實驗通入的CO2的體積比為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產鉛蓄電池時,在兩極板上的鉛、銻合金棚架上均勻涂上膏狀的PbSO4,干燥后再安裝,充電后即可使用,發生的反應是2PbSO4+2H2O![]() PbO2+Pb+2H2SO4下列對鉛蓄電池的說法錯誤的是( )
PbO2+Pb+2H2SO4下列對鉛蓄電池的說法錯誤的是( )
A. 需要定期補充硫酸
B. 工作時鉛是負極,PbO2是正極
C. 工作時負極上發生的反應是Pb-2e-+SO42-===PbSO4
D. 工作時電解質的密度減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com