
【題目】(1)Br位于元素周期表第_____周期第_____族;基態Na+核外有_____種運動狀態不同的電子;Mg基態原子核外電子排布式為_____。
(2)用“>”或“<”填空:
第一電離能 | 粒子半徑 | 熔點 | 鍵的極性 |
N_____S | S2—_____ Mg2+ | SO3______Na2O2 | H﹣O_____H﹣N |
(3)已知多硫化鈉﹣溴儲能電池是一種二次電池,結構如圖。電池總反應為:2Na2S3+2NaBr![]() 3Na2S2+Br2。
3Na2S2+Br2。
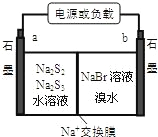
①放電時Na+向_____極遷移(填“a 或 b”);
②充電時陰極電極反應式為:______________。
(4)已知N4為正四面體結構,N﹣N鍵能為167kJ/mol,N≡N 鍵能為 942kJ/mol。寫 出N4(g)轉化為N2(g)的熱化學方程式________________。
【答案】 四 ⅦA 10 1s22s22p63s2 > > < > b 2S32—+2e—=3S22— N4(g)=2N2(g)△H=﹣882kJ/mol
【解析】
(1)Br的原子序數為35,原子結構中有4個電子層,最外層電子數為7;Na的質子數為11,基態Na+核外有10個電子;Mg基態原子核外12個電子;
(2)非金屬性越強,第一電離能越大;電子層越多,離子半徑越大;離子晶體的熔點大于分子晶體的熔點;O的非金屬性比N的強,則鍵的極性強;
(3) ①原電池中,陽離子向正極移動;②充電時陰極與電源負極相連,陰極得到電子發生還原反應;
(4)由信息可以知道N4(g)=2N2(g) △H=6×E(N﹣N)﹣2×E(N≡N),以此來解答。
(1)Br的原子序數為35,原子結構中有4個電子層,最外層電子數為 7,則位于第四周期ⅦA族;Na的質子數為 11,基態 Na+核外有10個電子,則有10種運動狀態不同的電子;Mg基態原子核外 12個電子,其基態原子核外電子排布式為 1s22s22p63s2。
因此,本題答案為:四;ⅦA;10;1s22s22p63s2;
(2)非金屬性N>S,第一電離能 N>S;電子層越多,離子半徑越大,則離子半徑為S2—>Mg2+;離子晶體的熔點大于分子晶體的熔點,則熔點為 SO3<Na2O2;O的非金屬性比 N 的強,則鍵的極性為H﹣O>H﹣N。
因此,本題答案為:>;>;<;>;
(3)由電池反應可知,放電時,Br2得到電子,S22—去電子,則a為負極,b為正極,①原電池中,陽離子向正極移動,則 Na+向 b移動②充電時陰極與電源負極相連,陰極得到電子發生還原反應,陰極電極反應式為2S32—+2e—=3S22—。
因此,本題答案為:b;2S32—+2e—=3S22—;
(4)由信息可知 N4(g)=2N2(g) △H=6×E(N﹣N)﹣2×E(N≡N)=6×167kJ/mol﹣2×942kJ/mol=﹣882kJ/mol,則熱化學方程式為 N4(g)=2N2(g)△H=﹣882kJ/mol。
因此,本題答案為:N4(g)=2N2(g)△H=﹣882kJ/mol。


科目:高中化學 來源: 題型:
【題目】如圖所示,當容器A中的反應開始后,若分別進行下列操作,請回答有關問題:
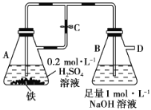
(1)若止水夾C打開,B容器中有什么現象發生:__________________________________________。
(2)若開始時止水夾C關閉,容器A中的反應還在進行時,B容器中有什么現象發生:_________________,寫出B容器中有關反應的化學方程式:_____________________。
(3)若先打開止水夾C一段時間,容器A中的反應還在進行時,再關閉止水夾C一會兒,B容器中有什么現象發生:_________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽酸、醋酸和氨水是中學化學中常見的三種物質,某校實驗小組利用濃鹽酸、冰醋酸和濃氨水分別配制了濃度均為0.1 mol·L-1的三種溶液各100 mL并進行相關實驗,據此回答下列問題:
(1)常溫下上述三種溶液的PH由大到小的順序是____________________。
(2)25℃時,利用pH試紙測得0.1 mol·L-1醋酸溶液的pH約為5,則可以估算出醋酸的電離常數約為__________________;向10 mL此溶液中加入少量冰醋酸,忽略溶解過程中溶液溫度和體積的微小變化,溶液中![]() 的值將_________(填“增大”“減小”或“無法確定”)。
的值將_________(填“增大”“減小”或“無法確定”)。
(3)將濃度均為0.1 mol·L-1的鹽酸和氨水等體積混合,則:①所得混合溶液顯_______性(填“酸性”“堿性”或“中性”),原因是__________________(用離子方程式表示)。
②所得混合溶液中所有離子的物質的量濃度由大到小的順序為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述中正確的是
4NO(g)+6H2O(g),下列敘述中正確的是
A.達到化學平衡狀態時,4v正(O2)= 5v逆(NO)
B.若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到化學平衡狀態
C.達到化學平衡狀態后,若增大容器容積,則正反應速率減小,逆反應速率增大
D.化學反應速率的關系為2v正(NH3)= 3v正(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】消毒劑在生產、生活中有重要的作用,常見的含氯消毒劑有NaClO2、NaClO、ClO2 和Cl2
回答下列問題:
(1)NaClO2所含的化學鍵類型有________________。
(2)消毒劑投入水中,一段時間后與氨結合得到一種結合性氯胺(NH2Cl)。NH2Cl 在中性或酸性條件下也是一種強殺菌消毒劑,常用于城市自來水消毒。其理由是________________(用化學方程式表示)。
(3) “有效氯含量”可用來衡量含氯消毒劑的消毒能力,其定義是每克含氯消毒劑的氧化能力相當于多少克Cl2 的氧化能力。上述四種含氯消毒劑中消毒能力最強的是________________。
(4)自來水廠用ClO2 處理后的水中,要求ClO2 的濃度在0.1~0.8 mg·L-1之間。用碘量法檢測ClO2 處理后的自來水中ClO2 濃度的實驗步驟如下:
步驟Ⅰ.取一定體積的水樣,加入足量碘化鉀,再用氫氧化鈉溶液調至中性,并加入淀粉溶液。
步驟Ⅱ.用Na2S2O3 溶液滴定步驟Ⅰ中所得的溶液。
已知:a. 操作時,不同pH 環境中粒子種類如下表所示。
pH | 2 | 7 |
粒子種類 | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-+2I-。
①步驟Ⅱ中反應結束時溶液呈___________(填“藍色”或“無色”)
②若水樣的體積為1.0L,在步驟Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,則該水樣中c(ClO2)=___________mg·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】β一受體阻滯劑鹽酸艾司洛爾(F)的一種合成路線如下:


已知:
回答下列問題:
(1)A的化學名稱是____________;F中含氧官能團的名稱是___________________。
(2)由B生成C的反應類型為____________,由D生成E的反應類型為____________。
(3)B的結構簡式為____________。
(4)由C生成D的化學方程式為____________。
(5)三取代芳香族化合物X是E的同分異構體,1molX與足量的NaHCO3反應可生成44.8L(標準狀況)CO2,其核磁共振氫譜顯示有5種不同化學環境的氫,且其峰面積之比為9:2:2:2:1。寫出2種符合要求的X的結構簡式:________________________________________________。
(6)寫出以苯甲醇和丙二酸為原料制備 的合成路線_____________(其他無機試劑任選)。
的合成路線_____________(其他無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質應用的說法中,不正確的是( )
A.Na2CO3是發酵粉的主要成分之一B.MgO常用作耐高溫材料
C.碘化銀可用于人工降雨D.氯氣可用于自來水消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關焰色反應的敘述中正確的是
A.只有金屬的化合物灼燒時才會有不同的焰色
B.每次實驗后,鉑絲都要用水洗凈
C.若透過藍色鈷玻璃只看到紫色,說明樣品中含K元素而不含Na元素
D.若樣品灼燒呈黃色,判斷一定有Na元素,但不能排除含其他金屬元素
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com