
【題目】乙炔是有機合成工業的一種原料。工業上曾用CaC2與水反應生成乙炔。
(1)CaC2中C22-與O22+互為等電子體,O22+的電子式可表示為_____________; lmol O22+中含有的π鍵數目為_______________。
(2)將乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2紅棕色沉淀。Cu+基態核外電子排布式為_________。
(3)乙炔與氫氰酸反應可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子軌道雜化類型是___________________;分子中處于同一直線上的原子數目最多為_______________。
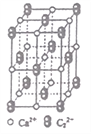
(4)CaC2晶體的晶胞結構與NaCl晶體的相似(如圖所示),則該晶胞中的碳原子個數為______。 CaC2晶體中含有的中啞鈴形C22-的存在,使晶胞沿一個方向拉長。CaC2 晶體中1個Ca2+周圍距離最近的C22-數目為_________________。
【答案】 ![]() 2NA 1s22s22p63s23p63d10 sp雜化 sp2雜化 3 8 4
2NA 1s22s22p63s23p63d10 sp雜化 sp2雜化 3 8 4
【解析】(1)等電子體的結構相似,故O22+的電子式與C22-的電子式相似,含有2個π鍵;(2)Cu為29號元素,得出Cu+的基態電子排布式為;(3)丙烯腈(H2C=CH-C≡N)中的C分別形成2個![]() 鍵和3個
鍵和3個![]() 鍵,故碳原子的雜化軌道類型為sp和sp2雜化,與sp雜化的C原子直接相連的原子有C和N,故同在一條直線上有3個原子;(4)根據均攤法分析晶體結構。
鍵,故碳原子的雜化軌道類型為sp和sp2雜化,與sp雜化的C原子直接相連的原子有C和N,故同在一條直線上有3個原子;(4)根據均攤法分析晶體結構。
(1)由C22-電子式為[∶CC∶]2-可推知O22+電子式為[∶OO∶]2+,氧氧三鍵中含兩個π鍵,1 mol O22+中含有π鍵數目為2NA。
(2)Cu+由Cu原子失去1個電子而得到,故基態核外電子排布式為1s22s22p63s23p63d10。
(3)丙烯腈分子中碳碳雙鍵為sp2雜化,—C≡N鍵為sp雜化,其分子中有一個三鍵,故共鍵的原子為C-C≡N即3個原子共線。因此,本題正確答案為:sp雜化 ;sp2雜化; 3
(4)由晶胞圖知C22-位于面心和頂點,根據均攤法,晶胞中的碳原子個數為=2×(8×![]() +6×
+6×![]() )=8;由晶體結構可知CaC2晶體中1個Ca2+周圍距離最近的C22-數目不是6個而是4個,因為啞鈴形C22-只向一個方向拉長,此方向上的兩個C22-與Ca2+距離不是最近,所以最近且等距的有4個。因此,本題正確答案為:8 ;4。
)=8;由晶體結構可知CaC2晶體中1個Ca2+周圍距離最近的C22-數目不是6個而是4個,因為啞鈴形C22-只向一個方向拉長,此方向上的兩個C22-與Ca2+距離不是最近,所以最近且等距的有4個。因此,本題正確答案為:8 ;4。


 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】甲醇、乙醇是生活中常見且用途廣泛的物質,其合成方法和性質均具有研究價值。
(1)已知下表中鍵能數據,則氣態乙醇完全燃燒生成CO2和水蒸氣的熱化學方程式為__________。
化學鍵 | C-C | C-H | O-O | H-O | C-O | C-O |
鍵能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容積可變的密閉容器中充入1mol CO與2 molH2,發生反應:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同溫度下的平衡轉化率(a)與壓強的關系如圖所示。
CH3OH(g) △H1<0。CO在不同溫度下的平衡轉化率(a)與壓強的關系如圖所示。
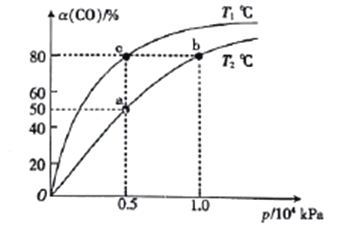
①a、b兩點的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③該合成反應的溫度一般控制在240~270℃,選擇此范圍的原因:此溫度范圍下的催化劑活性高;__________________________。
④圖中a、b、c三點對應的化學平衡常教K(a)、K(b)、K(c)的大小關系為_________。
(3)利用合成氣(主要成分為CO和H2)合成甲醇,主要發生如下反應:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反應對應的平衡常數分別為K1、K2、K3,其中K1、K2隨溫度的變化如圖所示。

則△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘在自然界中有很多存在形式,在地殼中主要以NaIO3 形式存在,在海水中主要以I-形式存在,幾種粒子與Cl2之間有以下轉化關系:
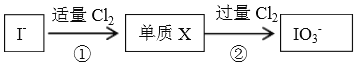
以下說法不正確的是
A. ①中發生的反應是:2I-+Cl2=I2+2Cl-
B. I-與過量Cl2發生的反應是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反應中,氯氣都體現氧化性,具體表現為:氯元素由0價降低為-1價
D. 通過以上信息,可預測:若在加入淀粉的KI溶液中逐滴滴加氯水,不能觀察到溶液變藍的現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pC類似pH,是指極稀溶液中,溶質物質的量濃度的常用對數負值。如某溶液溶質的濃度為1×10-3mol·L-1,則該溶液中溶質的pC=-lg(1×10-3)=3。如圖為H2CO3在加入強酸或強堿溶液后,平衡時溶液中三種成分的pC-pH圖。下列說法不正確的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3電離平衡常數Ka1≈10-6
C. pH=7時,溶液中存在關系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9時,溶液中存在關系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的固定意義重大,氮肥的大面積使用提高了糧食產量。
(1)目前人工固氮有效且有意義的方法是_______________(用一個化學方程式表示)。
(2)自然界發生的一個固氮反應是N2(B)+O2(g) ![]() 2NO(g),已知N2、O2、NO三種分子中化學鍵斷裂所吸收的能量依次為946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,則該反應的△H=____kJ·mol-1。
2NO(g),已知N2、O2、NO三種分子中化學鍵斷裂所吸收的能量依次為946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,則該反應的△H=____kJ·mol-1。
(3)恒壓100kPa時,反應2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡轉化率與溫度的關系曲線如圖1,反應2NO2(g)
2NO2(g)中NO的平衡轉化率與溫度的關系曲線如圖1,反應2NO2(g)![]() N2O4(g)中NO2的平衡轉化率與溫度的關系曲線如圖2。
N2O4(g)中NO2的平衡轉化率與溫度的關系曲線如圖2。
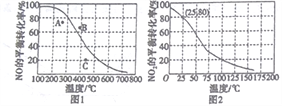
①圖1中A、B、C三點表示不同溫度、壓強下2NO(g)+O2(g)![]() 2NO2(g)達到平衡時NO的轉化率,則____________點對應的壓強最大。
2NO2(g)達到平衡時NO的轉化率,則____________點對應的壓強最大。
②恒壓100kPa、25℃時,2NO2(g) ![]() N2O4(g)平衡體系中N2O4的物質的量分數為______________,列式計算平衡常數Kp=____________。(Kp用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
N2O4(g)平衡體系中N2O4的物質的量分數為______________,列式計算平衡常數Kp=____________。(Kp用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
(4)室溫下,用往射器吸入一定量NO2氣體,將針頭插入膠塞密封,然后迅速將氣體體積壓縮為原來的一半并使活塞固定,此時手握針筒有熱感,繼續放置一段時間。從活塞固定時開始觀察,氣體顏色逐漸__________(填“變深”或“變淺”),原因是________________。[已知2NO2(g)![]() N2O4(g)在幾微秒內即可達到化學平衡]
N2O4(g)在幾微秒內即可達到化學平衡]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為合成氨反應(N2+ 3H2![]() 2NH3 ΔH<0 )中氮氣反應速率v(N2)變化的圖象,則橫坐標不可能的是
2NH3 ΔH<0 )中氮氣反應速率v(N2)變化的圖象,則橫坐標不可能的是

A. 溫度(T/K) B. 壓強(P/Pa)
C. 反應時間(t/min) D. 氮氣濃度(c/mol·L―1)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據下列有關規定的情景填空。
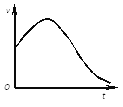
(1)①下圖是除去氧化膜的鎂條投入稀鹽酸中產生氫氣的速率隨時間的變化關系,曲線前段出現高峰的主要影響因素是________。
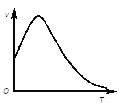
②下圖是過氧化氫在酶的催化作用下分解速率隨溫度的變化關系,曲線后段明顯下降的主要影響因素是__。
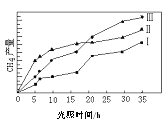
(2)利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2。紫外光照射時,在不同催化劑(I、II、III)作用下,CH4產量隨光照時間的變化見圖。在0~15小時內,CH4的平均生成速率I、II和III從大到小的順序為_________(填序號)。
(3)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系見圖。
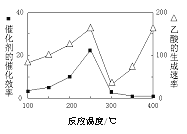
①250~300℃時,溫度升高而乙酸的生成速率降低的原因是_____________。
②當溫度的取值范圍在________時,溫度是影響乙酸的生成速率的主要因素。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取7.90gKMnO4,加熱分解后剩余固體7.42g。該剩余固體與足量的濃鹽酸在加熱條件下充分反應,生成單質氣體A,產物中錳元素以Mn2+存在。
請計算:
(1)KMnO4的分解率_______________。
(2)氣體A的物質的量_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食品包裝袋中有一個小紙袋,上面寫著“石灰干燥劑”。
(1)“石灰干燥劑”的主要成分石灰是______________(填化學式),石灰所屬的物質類型__________________(填序號)。
①金屬氧化物 ②堿性氧化物 ③堿 ④堿性干燥劑 ⑤純凈物 ⑥化合物 ⑦鹽
(2)生石灰可做干燥劑的理由是________________________(用化學方程式表示)。
(3)你認為下列內容還必須在這種小紙袋上注明的是____________(填序號)。
①禁止食用 ②可以食用 ③禁止未成年人用手拿 ④生產日期
(4)小紙袋中的物質能否長期地作干燥劑?為什么?_______________________________。
(5)某同學將濃硫酸、氫氧化鈉固體、生石灰等物質劃分為一類。該同學的分類依據為____________(填字母)。
A. 酸類 B. 堿類 C. 氧化物 D. 干燥劑
(6)生石灰還可以跟哪些類別的物質發生化學反應?請列舉三例并填表。__________________、__________________、__________________、__________________、__________________、__________________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com