
【題目】下列說法中,正確的是( )
A. 第ⅠA族元素的金屬性一定比ⅡA族元素的金屬性強
B. 除短周期外,其他周期均有18種元素
C. 短周期中,同周期元素的離子半徑從左到右逐漸減小
D. 主族是由短周期元素和長周期元素共同組成的族
科目:高中化學 來源: 題型:
【題目】將各0.05 mol的下列物質置于500 mL水中充分攪拌后,溶液中陰離子數目最多的是
A.NH4BrB.K2SO4C.Mg(OH)2D.Na2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組對Cu與H2SO4反應的產物種類和性質進行探究. Ⅰ.產物種類探究
在銅與濃硫酸反應的過程中,發現有黑色物質出現,經查閱文獻獲得下列資料.
資料1:X射線晶體分析表明,銅與濃硫酸反應生成的黑色物質為中的一種或兩種.
資料2:
硫酸/molL﹣1 | 黑色物質出現的溫度/°C | 黑色物質消失的溫度/°C |
15 | 約150 | 約236 |
16 | 約140 | 約250 |
18 | 約120 | 不消失 |
(1)由上述資料2可得出的正確結論是(選填下列字母編號) a.銅與濃硫酸反應時所涉及的反應可能不止一個
b.硫酸濃度選擇適當,可避免最后產物中出現黑色物質
c.該反應發生的條件之一是硫酸濃度>15molL﹣1
d.硫酸濃度越大,黑色物質出現越快,越難消失
(2)Cu與足量16molL﹣1濃硫酸反應時,在80°C以后,隨著溫度的逐漸升高,反應中硫酸銅的生成逐漸增加,而CuS卻逐漸減少,到達250°C左右時,CuS在反應中完全消失的澄清溶液,CuS消失的化學方程式為 .
(3)Ⅱ.產物性質探究 Cu與濃H2SO4反應生成的CuSO4具有某些特定性質,一定濃度CuSO4溶液與NaHCO3溶液反應后生成藍綠色顆粒狀沉淀,沉淀可能是CuCO3 , Cu(OH)2 , 或者CuCO3與Cu(OH)2的混合物.
1)若沉淀是Cu(OH)2 , 生成沉淀的離子方程式是 .
2)為了進一步探究沉淀的成分,設計的實驗裝置如圖:
實驗操作步驟為
a.取沉淀樣品100克于B中,檢查裝置的氣密性
b.打開K1 , K3 , 關閉K2 , K4 , 通入足量空氣
c.關閉K1 , K3 , 打開K2 , K4 , 充分反應
d.反應結束后,關閉K2 , 打開K1 , 再通入足量空氣
e.測得裝置D的質量增加了22g
①步驟b的作用是
②若沉淀樣品為CuCO3和Cu(OH)2的混合物,則Cu(OH)2的質量分數為 , 若不進行步驟d,則會使測得Cu(OH)2的質量分數為(填“偏高”“無影響”“偏低”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】均由兩種短周期元素組成的A、B、C、D化合物分子,都含有18個電子,它們分子中所含原子的數目依次為2、3、4、6。A和C分子中的原子個數比為1:1,B和D分子中的原子個數比為1:2。D可作為火箭推進劑的燃料。請回答下列問題。
(1)A、B、C、D分子中相對原子質量較大的四種元素第一電離能由大到小排列的順序為(用元素符號回答)。
(2)A與HF相比,其熔、沸點較低,原因是。
(3)B分子的立體構型為形,該分子屬于分子(填“極性”或“非極性”)。由此可以預測B分子在水中的溶解度較(“大”或“小”)。
(4)A、B兩分子的中心原子的最高價氧化物對應的水化物的酸性強弱為(填化學式)。
若設A的中心原子為X,B的中心原子為Y,比較下列物質的酸性強弱(填“>”“<”或“=”):
HXOHXO3HXO4;
H2YO3H2YO4。
(5)D分子中心原子的雜化方式是 , 由該原子組成的單質分子中包含個π鍵,與該單質分子互為等電子體的常見分子的分子式為。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、W四種短周期主族元素在周期表中的相對位置如圖所示,下列說法中正確的是( ) 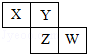
A.W的原子序數不可能是X的原子序數的3倍
B.Z元素可能是金屬元素
C.W的氣態氫化物的穩定性一定比Y的強
D.四種元素的原子有可能均能與氫原子形成18電子分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化劑是 , 氧化產物是 , 氧化產物與還原產物物質的量之比是 , 被氧化與未被氧化的HCl的質量之比為 , 若有7.3g HCl被氧化,則產生Cl2的質量為g,轉移的電子數為mol.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定質量的鋁鐵合金溶于足量的NaOH溶液中,完全反應后產生3.36 L(標準狀況下)氣體;用同樣質量的鋁鐵合金完全溶于足量的鹽酸中,在標準狀況下產生5.6 L的氣體。該合金中鋁、鐵的物質的量之比為( )
A.1∶1
B.2∶5
C.3∶2
D.3∶5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com