
【題目】溶液的酸堿性可用酸度(AG)表示,已知AG =lg![]() ,室溫下將0.01molL﹣l鹽酸逐滴滴入20.00mL 0.01 molL﹣l氨水中,溶液的AG變化如圖所示,下列說法正確的是
,室溫下將0.01molL﹣l鹽酸逐滴滴入20.00mL 0.01 molL﹣l氨水中,溶液的AG變化如圖所示,下列說法正確的是
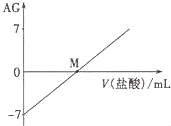
A.室溫下,0.01 molL﹣l鹽酸的AG=12
B.M點時溶液中:c(NH4+)=c(Cl﹣)
C.M點加入鹽酸的體積大于20.00 mL
D.M點以后NH4+的水解程度逐漸增大
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某化學反應的△H=-122kJmol-1,△S=+231Jmol-1K-1,則此反應在下列哪種情況下可自發進行( )
A. 在任何溫度下都能自發進行 B. 在任何溫度下都不能自發進行
C. 僅在高溫下自發進行 D. 僅在低溫下自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蘋果酸的結構簡式為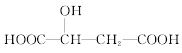 ,下列說法正確的是( )
,下列說法正確的是( )
A.蘋果酸中能發生酯化反應的官能團有2種
B.1 mol蘋果酸可與3 mol NaOH發生中和反應
C.1 mol蘋果酸與足量金屬Na反應生成1 mol H2
D.![]() 與蘋果酸互為同分異構體
與蘋果酸互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關反應熱的敘述中正確的是
①已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,則氫氣的燃燒熱為△H=-241.8kJ·mol-1
②由單質A轉化為單質B是一個吸熱過程,由此可知單質B比單質A穩定
③X(g)+Y(g)![]() Z(g)+W(s) △H>0,恒溫恒容條件下達到平衡后加入X,上述反應的△H增大
Z(g)+W(s) △H>0,恒溫恒容條件下達到平衡后加入X,上述反應的△H增大
④已知:
共價鍵 | C—C | C=C | C—H | H—H |
鍵能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表數據可以計算出 的焓變
的焓變
⑤根據蓋斯定律,推知在相同條件下,金剛石或石墨燃燒生成1molCO2固體時,放出的熱量相等
⑥25℃,101kPa,1mol碳完全燃燒生成CO2所放出的熱量為碳的燃燒熱
A.①②③④ B.③④⑤ C.④⑤ D.⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不能說明醋酸是弱電解質的是
A. 醋酸溶液導電性差 B. 醋酸溶液中存在醋酸分子
C. 醋酸鈉溶液呈堿性 D. 0.1 mol/L醋酸溶液的pH=2.9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2是一種重要的無機功能材料,粗MnO2的提純是工業生產的重要環節。某研究性學習小組設計了將粗MnO2(含有較多的MnO和MnCO3)樣品轉化為純MnO2的實驗,其流程如下:
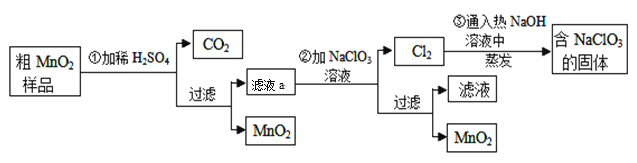
(1)第①步加稀H2SO4時,粗MnO2樣品中的 (寫化學式)轉化為可溶性物質。
(2)寫出濾液a與NaClO3溶液反應的離子方程式: 。
(3)第③步蒸發操作必需的儀器有鐵架臺(含鐵圈)、 、 、 ,已知蒸發得到的固體中有NaClO3和NaOH,則一定還含有 (寫化學式)。
(4)該流程中可以循環利用的物質是 和 。
(5)若粗MnO2樣品的質量為13.40g,加入稀H2SO4后,經過濾得到8.7g MnO2,并收集到0.224 L CO2(標準狀況下),則濾液a與NaClO3溶液反應時至少需要 mol NaClO3才能將濾液a中的Mn2+完全轉化為MnO2。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、W為五種短周期元素。X原子的質子數與電子層數相同,W原子核外電子數是M原子最外層電子數的2倍,Y、Z、M、W在周期表中的相對位置如圖所示。下列說法不正確的是( )
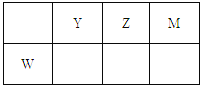
A. 原子半徑:W>Y>Z>M>X
B. 熱穩定性:XM>X2Z,沸點:X2Z>YX3
C. X、Y、Z三種元素形成的化合物中不可能含離子鍵
D. YM3、WM4分子中每個原子最外層均滿足8電子結構
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com