
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6種元素的代號。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
(10分) (1)+2價; O2->Na+或Na+<O2- (2) 1S22S22P63S23P4
(3)F> N > O (4)HN3+OH-=N+H2O
解析試題分析:根據元素在周期表中的位置可知,X是氮元素,Y是氧元素,Z是F元素,R是S元素,W是Br元素,J是Xe元素。
(1) F元素的非金屬性強于氧元素,則在化合物YZ2中Y的化合價為+2價。Y2-與Na+的核外電子排布相同,則微粒半徑隨原子序數的增大而減小,即微粒半徑大小為O2->Na+或Na+<O2-。
(2)S原子的原子序數是16,則根據工作原理可知,S原子的基態電子排布式為1S22S22P63S23P4。
(3)非金屬性越強,第一電離能越大。由于氮元素的2p軌道電子處于半充滿狀態,所以氮元素的第一電離能大于氧元素的,則在X、Y、Z三種元素中,第一電離能由大到小的順序是F>N>O。
(4)醋酸是一元弱酸,則如果酸HX3的酸性與醋酸相近,那么HX3溶液與NaOH溶液反應的離子方程式為HN3+OH-=N+H2O。
考點:考查元素推斷、核外電子排布式、微粒半徑比較、化合價以及第一電離能的大小比較
點評:該題是高考中的常見題型,屬于中等難度的試題。試題基礎性強強,側重對學生能力的培養和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的應試能力和邏輯推理能力。該題以“周期表中元素的推斷”為載體,比較全面考查學生有關元素推斷知識和靈活運用知識的能力。考查學生對元素周期表的熟悉程度及其對表中各元素性質和相應原子結構的周期性遞變規律的認識和掌握程度。考查了學生對物質結構與性質關系以及運用元素周期律解決具體化學問題的能力。


科目:高中化學 來源: 題型:填空題
下圖是元素周期表的一部分,其中每個數字編號代表對應的一種元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下圖是部分短周期元素的常見化合價與原子序數的關系圖: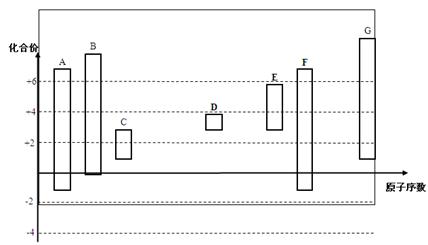
(1)元素A在周期表中的位置 。
(2)用電子式表示D2G的形成過程 其所含化學鍵類型為 。
(3)C2-、D+、G2-離子半徑大小順序是 > > (用離子符號回答)
(4)某同學設計實驗證明A、B、F的非金屬性強弱關系。 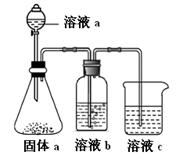
① 溶液a和b分別為 , 。
② 溶液c中的離子方程式為 。
③請從原子結構的角度解釋非金屬性B > A的原因 。
(5)將0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 轉移電子的物質的量為 。
② 用一個離子方程式表示該反應 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
W、X、Y、Z為短周期內除稀有氣體元素外的四種元素。它們的原子序數依次增大,其中只有Y是金屬元素,Y的最外層電子數和W的最外層電子數相等,X、Z為同一主族,Y、Z兩種元素的質子數之和為W、X兩種元素質子之和的3倍。由此可知元素W為 ,X為 ,Y為 ,Z 。上述元素中任意三種元素組成的既含有離子鍵又含有共價鍵的化合物化學式為 (至少寫三種)。能形成共價化合物的化學式有 、 、 、 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表是元素周期表的一部分,表中所列字母分別代表某一化學元素。
(1)在以上字母表示的短周期主族元素中,原子半徑最大的是__________(填元素符號)。
(2)i元素在周期表中的位置是__________。運用元素周期律判斷,i元素的正二價硫酸鹽是__________(難溶或易溶)于水的固體。
(3)請用電子式表示a與g組成的化合物的形成過程____________________。
(4)X、Y為同周期金屬元素,它們簡單離子的電子層與d離子的電子層結構相同,Y離子半徑在同周期元素簡單離子半徑中最小,X、Y兩元素最高價氧化物對應的水化物之間可以相互反應生成鹽和水,寫出該反應的離子方程式____________________;X與d的單質在加熱條件下生成的化合物中存在的化學鍵類型是____________________。
(5)工業上制取Y和g的無水化合物方法如下:Y的氧化物與b、g的單質在高溫條件下反應,每消耗6 kg b的單質,過程中轉移1×10 mol電子,寫出相應反應的化學方程式_______。
mol電子,寫出相應反應的化學方程式_______。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有A、B、C、D、E五種短周期元素,且相鄰的A、B、C、D四種元素原子核外共有56個電子,在周期表中的位置如圖所示。E的氫氧化物是兩性氫氧化物, E的陽離子與A的陰離子核外電子層結構相同。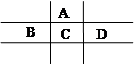
請回答下列問題:
⑴C元素在周期表中的位置為 。
⑵寫出A與氫元素能形成原子物質的量之比為1∶1的化合物的結構式 ,分子中所含共價鍵的類型為 。
⑶比較A、C氫化物的穩定性:A C(填大于、小于或等于),原因是 。
⑷B、C、D的原子半徑由大到小的順序為(用元素符號表示) 。
⑸若將E制作成電極與石墨用導線相連,回答下列問題:
將兩電極插入盛有稀H2SO4的燒杯中形成原電池,E電極為 極,寫出該電池的負極的電極反應是: ;電池總反應(用離子方程式表示) 。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(15分)(1)碳、氮、氧的第一電離能大小順序為 ,氧原子電子排布式為 。
(2)氨分子氮原子雜化類型 ,氨水中四種氫鍵哪一種是主要的 ,規律是什么? 。畫出氫氟酸溶液中最主要氫鍵 。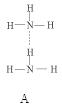
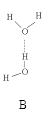
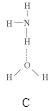
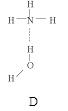
(3)DNA中四種堿基間通過氫鍵可能的配對方式,用虛線把氫鍵表示出來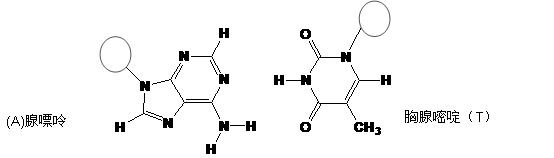

(4)試分析富馬酸的K2大于其順式異構體馬來酸K2的原因。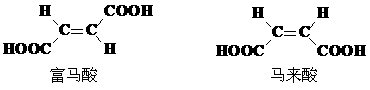
(5)下表是三種火箭推進劑的沸點,為什么火箭推進劑選擇氮元素? 。
| 物質 | H2 | N2H4 | H2NN(CH3)2 |
| 沸點/℃ | -252.8 | 113.5 | ~116 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
已知M2+3d軌道上有5個電子,試推出:
(1)M原子的核外電子排布。
(2)M原子的最外層和最高能級組中電子數各為多少?
(3)M元素在周期表中的位置。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com