
【題目】某研究小組為了探究一種有機鹽 X(僅含四種元素)的組成與性質,設計并完成如下實驗:
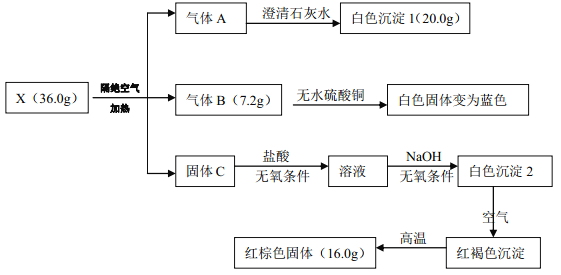
已知: A、 B、 C 均為常見物質
(1)有機鹽 X 的化學式:_______。
(2)寫出 X 受熱分解的化學方程式:_______。
(3)一定條件下,固體 C 與氣體 A 中的某一成分可能發生某一氧化還原反應生成紅棕色固體, 寫出此可能的化學方程式_______。
【答案】 FeC2O4·2H2O FeC2O4·2H2O = FeO+2H2O+CO+CO2 2FeO+ CO2= Fe2O3+ CO
【解析】試題分析: 由題意可知,有機鹽X隔絕空氣加熱分解得到常見物質A、 B、 C,A能使澄清的石灰水變渾,則A中含二氧化碳氣體;B能使無水硫酸銅變藍,則C為水蒸氣;C可溶于鹽酸,所得溶液在無氧條件下與氫氧化鈉反應可生成白色沉淀,白色沉淀在空氣中變化紅褐色沉淀,該沉淀高溫條件下變為紅棕色固體,綜合這些現象可知C為氧化亞鐵、紅棕色固體為氧化鐵。n(FeO)=2n(Fe2O3)= ![]() ,n(H2O)=
,n(H2O)= ![]() ,n(CO2)=
,n(CO2)= ![]() ,因為X僅含四種元素,所以n(CO)=
,因為X僅含四種元素,所以n(CO)= ![]() 。n(Fe):n(C):n(O):n(H)=0.2:0.4:1.2:0.8=1:2:6:4,所以X的化學式為FeC2O6H4 或FeC2O4·2H2O(二水合草酸亞鐵)。
。n(Fe):n(C):n(O):n(H)=0.2:0.4:1.2:0.8=1:2:6:4,所以X的化學式為FeC2O6H4 或FeC2O4·2H2O(二水合草酸亞鐵)。
(1)礦物鹽 X 的化學式:FeC2O4·2H2O。
(2)寫出 X 受熱分解的化學方程式:FeC2O4·2H2O = FeO+2H2O+CO↑+CO2↑。
(3)一定條件下,固體 FeO 與氣體 A 中的某一成分可能發生某一氧化還原反應生成紅棕色固體,可能是CO2與其反應,化學方程式為2FeO+ CO2= Fe2O3+ CO。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.非金屬元素的原子間不能形成離子化合物
B.Cl2、Br2、I2的分子間作用力依次增強,熔沸點依次升高
C.氯化氫氣體溶于水共價鍵被破壞
D.100℃時水由液態變為氣態,分子間作用力被破壞
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】膽礬CuSO4·5H2O可寫[Cu(H2O)4]SO4·H2O,其結構示意圖如下:
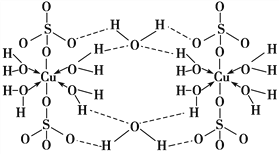
下列有關膽礬的說法正確的是( )
A. 所有氧原子都采取sp3雜化 B. 氧原子參與形成配位鍵和氫鍵兩種化學鍵
C. Cu2+的價電子排布式為3d84s1 D. 膽礬中的水在不同溫度下會分步失去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述錯誤的是

A.含16 g氧原子的二氧化硅晶體中含有的δ鍵數目為2NA
B.23.4 g NaCl晶體中含有0.1NA個如圖所示的結構單元
C.常溫常壓下,5 g D2O含有的質子數、電子數、中子數均為2.5NA
D.2 mol SO2和1 mol O2在一定條件下反應所得混合氣體分子數小于2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,不同酸性條件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)與溶液pH的變化關系如圖所示。下列說法正確的是

A. 隨著溶液pH增大,![]() 不斷增大
不斷增大
B. 由水電離出的c(H+):Q>X=Y
C. HF的電離常數Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH約為8.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將NO2裝入帶有活塞的密閉容器中,當反應2NO2(g)![]() N2O4(g)達到平衡后,改變下列一個條件,下列敘述正確的是
N2O4(g)達到平衡后,改變下列一個條件,下列敘述正確的是
A. 升高溫度,氣體顏色加深,則此反應為吸熱反應
B. 慢慢壓縮氣體體積,平衡向正反應方向移動,混合氣體的顏色變淺
C. 慢慢壓縮氣體體積,若體積減小一半,壓強增大,但小于原來的兩倍
D. 恒溫恒容時,充入稀有氣體,壓強增大,平衡向正反應方向移動,混合氣體的顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘是人體不可缺乏的元素,為了防止碘缺乏,現在市場上流行一種加碘鹽,就是在精鹽中添加一定量的KIO3進去。某研究小組為了檢測某加碘鹽中是否含有碘,查閱了有關的資料,發現其檢測原理是:KIO3+5KI
+3H2SO4=3I2+3H2O+3K2SO4
(1)該反應的氧化劑是_________;氧化產物與還原產物的物質的量比是__________;如果反應生成0.3mol的單質碘,則轉移的電子數目是_______。
(2)先取少量的加碘鹽加蒸餾水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振蕩,這時候,觀察到的現象是___________________________;
(3)若采用下圖實驗裝置將四氯化碳和I2的混合溶液分離。

寫出圖中儀器的名稱:①_____;該裝置還缺少的儀器是_____;冷凝管的進水口是:_____(填g或f)
(4)在容量瓶的使用方法中,下列操作正確的是____________
A.使用容量瓶前檢驗是否漏水
B.容量瓶用水洗凈后,再用待配溶液洗滌
C.配制溶液時,若試樣是液體,用量筒取樣后用玻璃棒引流倒入容量瓶中,緩慢加水至刻度線1~2cm處,用膠頭滴管加蒸餾水至刻度線。
D.蓋好瓶塞,用食指頂住瓶塞,另一只手托住瓶底,把容量瓶反復倒轉多次,搖勻。
(5)上面實驗中用到一定物質的量濃度的稀硫酸,若配制0.5mol/L的硫酸溶液500mL,需用量筒量取質量分數為98%、密度為1.84g/cm3的濃硫酸的體積為_______ mL,如果實驗室有15mL、20mL、50mL量筒,應選用________ mL量筒最好。
(6)下面操作造成所配稀硫酸溶液濃度偏高的是_____________。
A.溶解的時候溶液沒有冷卻到室溫就轉移
B.轉移時沒有洗滌燒杯、玻璃棒
C.向容量瓶加水定容時眼睛俯視
D.用量筒量取濃硫酸后洗滌量筒并把洗滌液轉移到容量瓶
E.搖勻后發現液面低于刻度線,又加蒸餾水至刻度線
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com