
【題目】為了更簡便地制取干燥的NH3 , 適合的方法是( )
A.NH4Cl與濃H2SO4混合共熱,生成的氣體用堿石灰進行干燥
B.N2+3H2 ![]() 2NH3 , 用燒堿進行干燥
2NH3 , 用燒堿進行干燥
C.加熱濃氨水,氣體用堿石灰干燥
D.加熱NH4HCO3 , 氣體用P2O5干燥
【答案】C
【解析】解:A.NH4Cl和H2SO4(濃)混合加熱得不到大量氨氣,不能用來實驗室制備,故A錯誤;B.N2與H2反應生成氨氣需要高溫高壓催化劑條件,且此反應是可逆反應,反應條件復雜,得到的產物不純凈,在實驗室中不能實現,故B錯誤;
C.濃氨水具有揮發性,加熱能夠促進氨氣的揮發,氨氣為堿性氣體,應選擇堿性干燥劑干燥,可以用堿石灰干燥,故C正確;
D.硝酸銨受熱容易發生爆炸,不能用來制備氨氣,P2O5也不可用來干燥氨氣,故D錯誤;
故選C.
【考點精析】利用氨的化學性質和氨的實驗室制法對題目進行判斷即可得到答案,需要熟知與水反應,NH3是惟一能使潤濕的紅色石蕊試紙交藍的氣體,常用此性質檢驗NH3;與酸反應:NH3+HCl=NH4Cl(生成白煙);與O2反應:4NH3+5O2=4NO+6H2O+Q;


 輕巧奪冠周測月考直通中考系列答案
輕巧奪冠周測月考直通中考系列答案科目:高中化學 來源: 題型:
【題目】碘在自然界中有很多存在形式,在地殼中主要以NaIO3 形式存在,在海水中主要以I-形式存在,幾種粒子與Cl2之間有以下轉化關系:
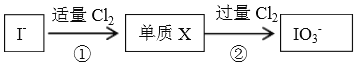
以下說法不正確的是
A. ①中發生的反應是:2I-+Cl2=I2+2Cl-
B. I-與過量Cl2發生的反應是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反應中,氯氣都體現氧化性,具體表現為:氯元素由0價降低為-1價
D. 通過以上信息,可預測:若在加入淀粉的KI溶液中逐滴滴加氯水,不能觀察到溶液變藍的現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2SO3溶液做為吸收液吸收SO2時,吸收液pH隨n( ![]() ):n(
):n( ![]() )變化的關系如表:
)變化的關系如表:
n( | 91:9 | 1:1 | 9:91 |
Ph | 8.2 | 7.2 | 6.2 |
以下離子濃度關系的判斷正確的是( )
A.NaHSO3溶液中c(H+)<c(OH﹣)
B.Na2SO3溶液中c(Na+)>c (SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.當吸收液呈中性時,c(Na+)>c(SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)=c(H+)
)>c(OH﹣)=c(H+)
D.當吸收液呈中性時,c(Na+)>c(HSO ![]() )+c(SO
)+c(SO ![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是可逆反應A+2B2C+3D的化學反應速率與化學平衡隨外界條件改變(先降溫后加壓)而變化的情況,由此可推斷( ) 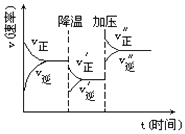
A.降溫后逆反應速率增大
B.逆反應是放熱反應
C.A,B,C,D均為氣體
D.若A,B是氣體,則D是液體或固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,把氣體緩慢通入盛有足量試劑的試劑瓶A和試管B,在試管B中不能觀察到明顯現象的是( )
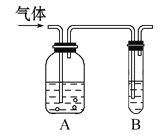
選項 | 氣體 | A中試劑 | B中試劑 |
A | SO2、CO2 | 酸性KMnO4溶液 | 澄清石灰水 |
B | Cl2、HCl | 飽和NaCl溶液 | KI淀粉溶液 |
C | CO2、HCl | 飽和NaHCO3溶液 | NaAlO2溶液 |
D | NH3、CO2 | 濃硫酸 | 酚酞試液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下將3mol CO2和2mol H2混合于2L的密閉容器中,發生如下反應:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)該反應的化學平衡常數表達式K= .
(2)已知在700℃時,該反應的平衡常數K1=0.6,則該溫度下反應CO(g)+H2O(g)CO2(g)+H2(g)的平衡常數K2= , 反應 ![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g) ![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常數K3= .
H2O(g)的平衡常數K3= .
(3)已知在1 000℃時,該反應的平衡常數K4為1.0,則該反應為反應(填“吸熱”或“放熱”).
(4)能判斷該反應達到化學平衡狀態的依據是
A.容器中壓強不變
B.c(CO2)=c(CO)
C.生成a mol CO2的同時消耗a mol H2
D.混合氣體的平均相對分子質量不變
(5)在1 000℃下,某時刻CO2的物質的量為2.0mol,則此時v(正)v(逆)(填“>”、
“=”或“<”).該溫度下反應達到平衡時,CO2的轉化率為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作均要用玻璃棒,其中玻璃棒作用相同的是( )
①過濾 ②蒸發 ③溶解 ④向容量瓶轉移液體 ⑤pH試紙的使用
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A為正鹽,常溫、常壓下,B、C、D、E、G、H、I均為氣體,其中D、G、H為單質,氣體B能使濕潤紅色石蕊試紙變藍,氣體E本身為無色氣體,但是與空氣接觸會生成一種紅棕色氣體I,H為黃綠色氣體。F在常溫下是一種無色液體。C、J的水溶液分別為兩種強酸。圖中反應條件(除加熱外)均已略去。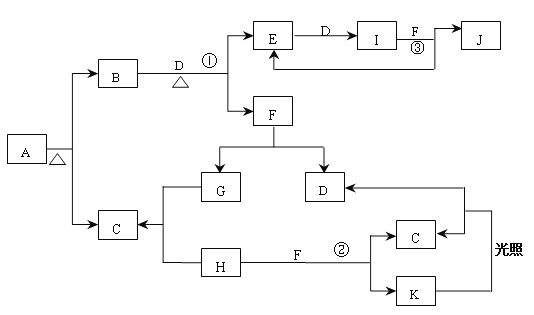
(1)寫出它們的化學式:A__________、C___________、J____________;
(2)實驗室制備氣體B的化學方程式為:___________________________________。
(3)寫出B+D→E+F 的化學方程式:__________________________________________。
(4)J的濃溶液與單質Cu反應的離子方程式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室欲用NaOH固體配制1.0 mol/L的NaOH溶液240 mL:
(1)配制溶液時,一般可以分為以下幾個步驟:①稱量②計算③溶解④倒轉搖勻⑤轉移⑥洗滌⑦定容⑧冷卻。
其正確的操作順序為___________ ⑤⑥⑤__________。本實驗必須用到的儀器有托盤天平、藥匙、玻璃棒、燒杯、膠頭滴管、還有_____________________。
(2)某同學欲稱量一定量的NaOH固體,他先用托盤天平稱量燒杯的質量,天平平衡后的狀態如圖,燒杯的實際質量為_________ g。要完成本實驗該同學應稱出_________ g NaOH。

(3)對所配制的NaOH溶液進行測定,發現其濃度低于1.0mol/L。在溶液配制過程中,下列操作會引起該誤差的有_________(填序號)。
A.轉移溶解的溶液后沒有洗滌燒杯和玻璃棒
B.轉移溶液時不慎有少量灑到容量瓶外面
C.容量瓶未干燥就用來配制溶液
D.稱量NaOH固體時動作太慢,耗時太長
E.定容后搖勻溶液,發現液面低于刻度線,再加入少量水使液面與刻度線相平
F.定容時仰視刻度線
G.NaOH固體溶解后未經冷卻即轉移到容量瓶中
(4)氫氧化鈉是一種用途十分廣泛的重要化工原料,工業上主要通過電解氯化鈉飽和溶液的方法![]() 。試用單線橋法標出該反應中電子轉移的方向和數目____________________。實驗測得,反應中生成的氣體在標準狀況下的體積為4.48L,則耗氧化劑的物質的量為_________mol。
。試用單線橋法標出該反應中電子轉移的方向和數目____________________。實驗測得,反應中生成的氣體在標準狀況下的體積為4.48L,則耗氧化劑的物質的量為_________mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com