
下列裝置的線路接通后,經過一段時間,溶液的pH值明顯下降的是
 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:實驗題
滴定實驗是化學學科中重要的定量實驗。
請回答下列問題:
(1)酸堿中和滴定——用標準鹽酸滴定未知濃度的NaOH溶液。
①下列操作造成測定結果偏高的是 (填選項字母)
A.滴定終點讀數時,俯視滴定管刻度,其他操作正確。
B.盛裝未知液的錐形瓶用蒸餾水洗過,未用未知液潤洗
C.酸式滴定管用蒸餾水洗凈后,未用標準鹽酸潤洗
D.滴定前,滴定管尖嘴有氣泡,滴定后氣泡消失
②該學生的實驗操作如下:
A、用堿式滴定管取稀NaOH 25.00mL,注入錐形瓶中,加入甲基橙做指示劑。
B、用待測定的溶液潤洗堿式滴定管。
C、用蒸餾水洗干凈滴定管。
D、取下酸式滴定管用標準的HCl溶液潤洗后,將標準液注入滴定管刻度“0”以上2~3cm處,再把滴定管固定好,調節液面至刻度“0”或“0”刻度以下。
E、檢查滴定管是否漏水。
F、另取錐形瓶,再重復操作一次。
G、把錐形瓶放在滴定管下面,瓶下墊一張白紙,邊滴邊搖動錐形瓶直至滴定終點,記下滴定管液面所在刻度。
a. 滴定操作的正確順序是(用序號填寫)___________________________ 。
b. 在G操作中如何確定終點? __________________________ ____ 。
c. 若換酚酞做指示劑,如何確定終點? _________________________ ____ 。
(2)氧化還原滴定—取草酸溶液置于錐形瓶中,加入適量稀硫酸,用濃度為0.1mol·L-1的高錳酸鉀溶液滴定,發生的反應為:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中記錄了實驗數據:
| 滴定次數 | 待測液體積 (mL)[來 | 標準KMnO4溶液體積(mL) | |
| 滴定前讀數 | 滴定后讀數 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 難溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 顏色 | 白 | 淺黃 | 白 | 磚紅 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
關于如圖所示的原電池,下列說法正確的是 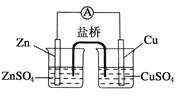
| A.鋅電極發生還原反應,銅電極發生氧化反應 |
| B.鹽橋中的陰離子向硫酸銅溶液中遷移 |
| C.電子從鋅電極通過電流計流向銅電極 |
| D.銅電極上發生的電極反應為2H++2e-===H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
如圖所示,下列敘述正確的是( ) 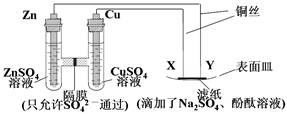
| A.隔膜左側溶液的質量增加,隔膜右側溶液的液面升高 |
| B.ZnSO4溶液與CuSO4溶液可以互換 |
| C.X與濾紙接觸處有氧氣生成 |
| D.Y與濾紙接觸處有氣泡產生,溶液逐漸變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
燃料電池是燃料(如H2、CO、CH4等)跟氧氣或空氣起反應,將化學能轉變為電能的裝置,電解液為強堿溶液。下列關于甲烷燃料電池的說法正確的是( )
| A.負極反應為CH4+10OH-→CO32-+7H2O+8e- |
| B.負極反應為O2+2H2O+4e-→4OH- |
| C.隨著放電進行,溶液中的陽離子向負極移動 |
| D.隨著放電進行,溶液的PH不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
鎂及其化合物一般無毒(或低毒)、無污染,且鎂原電池放電時電壓高而平穩。其中一種鎂電池的反應為xMg+Mo3S4 MgxMo3S4,下列說法錯誤的是( )
MgxMo3S4,下列說法錯誤的是( )
| A.放電時Mg2+向正極遷移 |
| B.放電時正極反應為Mo3S4+2xe-===Mo3S42x- |
| C.充電時Mo3S4發生氧化反應 |
| D.充電時陰極反應為Mg2++2e-===Mg |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關金屬鐵的腐蝕與防護,說法正確的是
| A.酸雨后易發生析氫腐蝕、炒鍋存留鹽液時易發生吸氧腐蝕 |
| B.當鍍錫鐵和鍍鋅鐵鍍層破損時,后者更易被腐蝕 |
| C.鐵與電源正極連接可實現電化學保護 |
| D.將鋼管與銅管一起堆放時可保護鋼管少受腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
堿性電池具有容量大、放電電流大的特點,因而得到廣泛應用。鋅—錳堿性電池以氫氧化鉀溶液為電解液,電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是
| A.電池工作時,電子由正極通過外電路流向負極 |
| B.電池工作時,鋅失去電子 |
| C.電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外電路中每通過0.2mol e-,鋅的質量理論上減小6.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
以純鋅作陰極,以石墨作陽極,電解某濃度的硫酸鋅溶液,陰極產物均附在電極上(陰極產物也不再參加反應損耗),通電一段時間后,關閉電源,迅速撤去電極,若在電解后的溶液中加入4.95 g Zn(OH)2固體,則恰好能使溶液恢復到原濃度,則整個電解過程中,所產生的氣體體積為(標準狀況)
| A.0.56 L | B.1.12 L | C.2.24 L | D.3.36 L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com