
【題目】KIO3是一種重要的無機化合物,可作為食鹽中的補碘劑。回答下列問題:
(1)KIO3的化學名稱是______________。
(2)利用“KClO3氧化法”制備KIO3工藝流程如下圖所示:

“酸化反應”所得產物有 KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是___________。“濾液”中的溶質主要是________________。“調pH”中發生反應的化學方程式為_________________________。
(3)KIO3也可采用“電解法”制備,裝置如圖所示。

①寫出電解時陰極的電極反應式_____________________________________。
②電解過程中通過陽離子交換膜的離子主要為_______________,其遷移方向是____________________。(“左到右”或“右到左”)
【答案】碘酸鉀 加熱 KCl KH(IO3)2+KOH===2KIO3+H2O或(HIO3+KOH===KIO3+H2O) 2H2O+2e-===2OH-+H2↑ K+ 由a到b
【解析】
(1)根據化學式可知KIO3為碘酸鉀;故答案為:碘酸鉀;
(2)將溶解在溶液中的氣體排出的一般方法是將溶液加熱,原因是氣體的溶解度是隨溫度上升而下減小。第一步反應得到的產品中氯氣在“逐Cl2”時除去,根據圖示,碘酸鉀在最后得到,所以過濾時KH(IO3)2應該在濾渣中,所以濾液中主要為KCl。“調pH”的主要目的是將KH(IO3)2轉化為KIO3,所以方程式為:KH(IO3)2+KOH=2KIO3+H2O;故答案為:加熱、KCl、KH(IO3)2+KOH===2KIO3+H2O或(HIO3+KOH===KIO3+H2O);
(3)①由圖示,陰極區溶液為氫氧化鉀溶液,所以水電離的氫離子得電子,反應為2H2O + 2e- = 2OH- + H2↑,故答案為:2H2O + 2e- = 2OH- + H2↑;
②電解時,溶液中的陽離子應該向陰極遷移,溶液中大量存在的鉀離子遷移,方向為由左向右,即由a到b,故答案為:K+ 、由a到b;


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:
【題目】合金是建造航空母艦的主體材料.
(1)航母升降機可由鋁合金制造.
①鋁元素在周期表中的位置為 ____________.
②Al-Mg合金焊接前用NaOH溶液處理Al2O3膜,其化學方程式為_________________.
(2)AlCl3也是重要的鋁鹽,無水AlCl3(183℃升華)遇潮濕空氣即產生大量白霧,實驗室可用下列裝置制備.
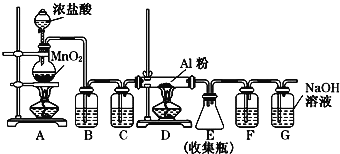
①裝置A中發生反應的離子方程式為_____________________________________.
②裝置B、C中盛放的試劑是B:__________ ,C:__________.
③裝置G的作用是__________.
④無水AlCl3遇潮濕空氣產生大量白霧的成分是__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列表達式錯誤的是
A. 甲烷的電子式:![]()
B. 碳原子的L層電子軌道表示式:![]()
C. 硫離子的核外電子排布式:1s22s22p63s23p6
D. 碳-12原子:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無機化合物的二聚分子結構如圖,該分子中A、B兩種元素都是第三周期的元素,分子中所有原子最外層都達到8電子穩定結構。關于該化合物的說法不正確的是( )

A. 化學式是Al2Cl6
B. 不存在離子鍵和非極性共價鍵
C. 在固態時所形成的晶體是分子晶體
D. 是離子化合物,在熔融狀態下能導電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 飽和Na2CO3溶液與CaSO4固體反應:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO堿性溶液與Fe(OH)3反應:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 電解飽和食鹽水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組設計了一組實驗來探究元素周期律。甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖裝置來一次性完成S、C、Si三種元素的非金屬性強弱比較的實驗研究。乙同學設計了如圖裝置來驗證鹵族元素的性質遞變規律,A、B、C三處分別是蘸有NaBr溶液的棉花、濕潤的淀粉KI試紙、濕潤紅紙。已知常溫下濃鹽酸與高錳酸鉀能反應生成氯氣。

(1)如圖中儀器A的名稱是____。甲同學實驗步驟:連接儀器、______、加藥品、滴入試劑。
(2)①如圖中儀器A中盛放試劑稀硫酸,燒瓶B中的盛放試劑為___溶液,C中的盛放試劑為______溶液。
②能說明碳元素的非金屬性比硅元素非金屬性強的實驗現象是_________。
(3)如圖中A處反應的離子方程式為__________。
(4)乙同學發現如圖中B處試紙變藍,C處紅紙褪色,據此____(填“能”或“不能”)得出溴的非金屬性強于碘,理由是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有六種短周期元素,原子序數逐漸增大。請根據以下信息,用元素符號回答下列問題:
L | 原子中只有一個電子 |
M | 原子的最外層電子數是次外層電子數的2倍 |
N | 地殼中含量最多的元素 |
Q | 所在的周期數是族序數的3倍 |
R | R2+具有與氖原子相同的電子層結構 |
T | 最高正化合價與最低負化合價的代數和為6 |
(1)寫出這兩種元素的名稱:M_________、Q________。
(2)T在周期表中的位置是______,T的原子結構示意圖為_______,T的最高價氧化物對應水化物的化學式為_______。
(3)上述六種元素中原子半徑最大的是__________,非金屬性最強的是____________。
(4)寫出MN2的電子式_________,用電子式表示化合物RT2的形成過程:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如圖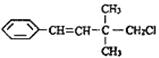 ,關于該有機物的下列敘述中不正確的是( )
,關于該有機物的下列敘述中不正確的是( )
A. 一定條件下,能發生加聚反應
B. 1mol該有機物在一定條件下最多能與4molH2發生反應
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 該有機物苯環上的一溴代物有3種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組構想將汽車尾氣(NO、NO2)轉化為重要的化工原料HNO3,其原理如圖所示,其中A、B為多孔材料.下列說法正確的是
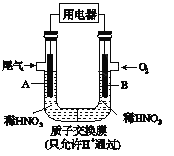
A. 電極A表面反應之一為NO2-e-+H2O= NO3_+2H+
B. 電極B附近的c(NO3_)增大
C. 電解質溶液中電流的方向由B到A,電子的流向與之相反
D. 該電池工作時,每轉移4mol電子,消耗22.4L O2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com