
【題目】海水是鎂的主要來源之一.從海水中提取鎂可按如下步驟進行:①把貝殼制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗滌、過濾沉淀物;③將沉淀物與鹽酸反應,結晶、過濾、干燥;④電解得到產物.
(1)以上提取鎂的全過程中,沒有涉及的化學反應類型是(填序號).
A.分解反應
B.化合反應
C.置換反應
D.復分解反應
(2)下列關于提取鎂的說法中不正確的是(填序號).
A.此法的優點之一是原料來自大海
B.進行①②③步驟的目的是富集MgCl2
C.可用電解熔融氧化鎂的方法制取鎂
D.電解冶煉鎂要消耗大量電能
(3)電解熔融氧化鎂制取鎂的化學反應方程式 .
(4)③中沉淀物與鹽酸反應的離子反應方程式 .
【答案】
(1)C
(2)C
(3)MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
(4)Mg(OH)2+H+=Mg2++H2O
【解析】解:(1)①把貝殼制成石灰乳,涉及的反應有分解、化合;
②在引入的海水中加入石灰乳,沉降、過濾、洗滌沉淀物,發生復分解反應;
③將沉淀物與鹽酸反應,結晶,過濾,得到含結晶水的晶體,發生復分解反應,將得到晶體在一定條件下加熱得到無水氯化鎂,涉及分解反應;
④電解熔融氯化鎂,得到金屬鎂,為分解反應;
以上提取鎂的全過程中,沒有涉及的化學反應類型是置換反應,故選C,
所以答案是:C;(2)A、海水中含有豐富的鎂離子,此法的優點之一是原料來源豐富,故A正確;
B、①將貝殼制成石灰乳;②在引入的海水中加入石灰乳、沉降、過濾、洗滌沉淀物氫氧化鎂;③將沉淀物與鹽酸反應、結晶、過濾、干燥產物氯化鎂晶體,是提取氯化鎂的反應過程,故B正確;
C、電解熔融氯化鎂生成鎂和氯氣,MgCl2 ![]() Mg+Cl2↑,氧化鎂熔點高不易熔融,消耗更多能源,故C錯誤;
Mg+Cl2↑,氧化鎂熔點高不易熔融,消耗更多能源,故C錯誤;
D.電解冶煉鎂是電解熔融氯化鎂要消耗大量電能,故D正確;
所以答案是:C;(3)電解熔融氯化鎂,得到金屬鎂和氯氣,電解熔融氧化鎂制取鎂的化學反應方程式為:MgCl2 ![]() Mg+Cl2↑,
Mg+Cl2↑,
所以答案是:MgCl2 ![]() Mg+Cl2↑;(4)③中沉淀物與鹽酸反應是氫氧化鎂和鹽酸反應生成氯化鎂溶液,反應的離子方程式為:Mg(OH)2+H+=Mg2++H2O,
Mg+Cl2↑;(4)③中沉淀物與鹽酸反應是氫氧化鎂和鹽酸反應生成氯化鎂溶液,反應的離子方程式為:Mg(OH)2+H+=Mg2++H2O,
所以答案是:Mg(OH)2+H+=Mg2++H2O.


科目:高中化學 來源: 題型:
【題目】兩種氣態烴以任意比例混合,在105℃時1 L該混合烴與9 L氧氣混合,充分燃燒后恢復到原狀態,所得氣體體積仍是10 L。下列各組混合烴中不符合此條件的是 ( )
A. CH4 C3H6 B. CH4 C2H4 C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家最近成功合成了世界上首個五氮陰離子鹽![]() (用
(用![]() 代表).回答下列問題:
代表).回答下列問題:
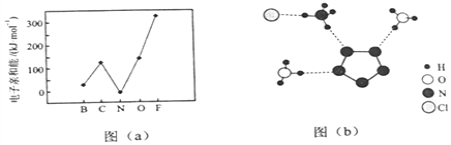
(1)氮原子價層電子對的軌道表達式(電子排布圖)為________.
(2)元素的基態氣態原子得到一個電子形成氣態負一價離子時所放出的能量稱作第一電子親和能![]() .第二周期部分元素的
.第二周期部分元素的![]() 變化趨勢如圖
變化趨勢如圖![]() 所示,其中除氮元素外,其他元素的
所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是________;氮元素的
自左而右依次增大的原因是________;氮元素的![]() 呈現異常的原因是________.
呈現異常的原因是________.
(3)經![]() 射線衍射測得化合物
射線衍射測得化合物![]() 的晶體結構,其局部結構如圖
的晶體結構,其局部結構如圖![]() 所示.
所示.
①從結構角度分析, ![]() 中兩種陽離子的相同之處為________,不同之處為________.(填標號)
中兩種陽離子的相同之處為________,不同之處為________.(填標號)
![]() .中心原子的雜化軌道類型
.中心原子的雜化軌道類型 ![]() .中心原子的價層電子對數
.中心原子的價層電子對數
![]() .立體結構
.立體結構 ![]() .共價鍵類型
.共價鍵類型
②![]() 中陰離子
中陰離子![]() 中的
中的![]() 鍵總數為________個.分子中的大
鍵總數為________個.分子中的大![]() 鍵可用符號
鍵可用符號![]() 表示,其中
表示,其中![]() 代表參與形成的大
代表參與形成的大![]() 鍵原子數,
鍵原子數, ![]() 代表參與形成的大
代表參與形成的大![]() 鍵電子數(如苯分子中的大
鍵電子數(如苯分子中的大![]() 鍵可表示為Π
鍵可表示為Π![]() ),則
),則![]() 中的大
中的大![]() 鍵應表示為________.
鍵應表示為________.
③圖![]() 中虛線代表氫鍵,其表示式為
中虛線代表氫鍵,其表示式為![]() 、________、________.
、________、________.
(4)![]() 的晶體密度為
的晶體密度為![]() ,其立方晶胞參數為
,其立方晶胞參數為![]() ,晶胞中含有
,晶胞中含有![]() 個
個![]() 單元,該單元的相對質量為
單元,該單元的相對質量為![]() ,則
,則![]() 的計算表達式為________.
的計算表達式為________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】數十年來,化學工作者對碳的氧化物和氫化物做了廣泛深入的研究并取得了一些重要成果. 已知:C(s)+O2(g)=CO2(g);△H=﹣393kJmol﹣1
2CO (g)+O2(g)=2CO2(g);△H=﹣566kJmol﹣1
2H2(g)+O2(g)=2H2O(g);△H=﹣484kJmol﹣1
(1)工業上常采用將水蒸氣噴到灼熱的炭層上實現煤的氣化(制得CO、H2),該反應的熱化學方程式是 .
(2)上述煤氣化過程中需向炭層交替噴入空氣和水蒸氣,噴入空氣的目的是;該氣化氣可在加熱和催化劑下合成液體燃料甲醇,該反應方程式為 .
(3)電子工業中使用的一氧化碳常以甲醇為原料通過脫氫、分解兩步反應得到. 第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0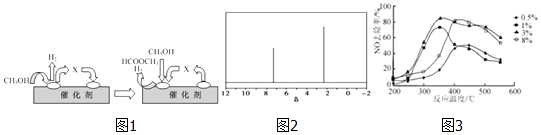
①第一步反應的機理可以用圖1表示:圖中中間產物X的結構簡式為 .
②以甲醇制一氧化碳的反應為反應(填“吸熱”、“放熱”).
(4)天然氣可重整生產化工原料,最近科學家們利用天然氣無氧催化重整獲得芳香烴X.由質譜分析得X的相對分子質量為106,其核磁共振氫譜如圖2,則X的結構簡式為 .
(5)C2H4可用于煙氣脫硝.為研究溫度、催化劑中Cu2+負載量對其NO去除率的影響,控制其他條件一定,實驗結果如3圖所示.為達到最高的NO去除率,應選擇的反應溫度和Cu2+負載量分別是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、R為五種短周期元素,其原子半徑和最外層電子數之間的關系如圖所示。下列說法正確的是( )

A. 簡單陽離子半徑:X>R
B. X與Y可以形成正四面體結構的分子
C. M的氫化物常溫常壓下為液體
D. 最高價氧化物對應水化物的酸性:Z<Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過碳酸鈉( Na2CO4)是一種很好的供氧劑,其與稀鹽酸反應的化學方程式為:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售過碳酸鈉一般都含有碳酸鈉,為測定某過碳酸鈉樣品(只含Na2CO4和Na2CO3)的純度,某化學興趣小組采用以下兩種方案實施:
方案一:![]()
(1)操作①和③的名稱分別為
(2)上述操作中,使用到玻璃棒的有 __(填操作序號)。
(3)請簡述操作③的操作過程
方案二:按下圖安裝好實驗裝置,Q為一塑料氣袋,隨意取適量樣品于其中,打開分液漏斗活塞,將稀鹽酸滴入氣袋中至充分反應。

(4)為測定反應生成氣體的總體積,滴稀鹽酸前必須關閉 ,打開 (填“K1”、“K2”或“K3”)。導管a的作用是 。
(5)當上述反應停止后,使K1、K3處于關閉狀態,K2處于打開狀態,再緩緩打開Kl。 B中裝的固體試劑是 ,為何要緩緩打開K1? 。
(6)實驗結束時,量筒I中有xmL水,量筒Ⅱ中收集到了ymL氣體,則樣品中過碳酸鈉的質量分數是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應一定不能自發的是( )
A.2KClO3(s)═2KCl(s)+3O2(g)△H=﹣78.03kJmol﹣1 △S=+1110 Jmol﹣1K﹣1
B.CO(g)═C(s,石墨)+ ![]() O2(g)△H=+110.5kJmol﹣1△S=﹣89.36 Jmol﹣1K﹣1
O2(g)△H=+110.5kJmol﹣1△S=﹣89.36 Jmol﹣1K﹣1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=﹣444.3kJmol﹣1△S=﹣280.1 J.mol﹣1K﹣1
D.NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l)△H=+37.301kJmol﹣1△S=+184.05 Jmol﹣1K﹣1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com