
可以證明可逆反應N2 + 3H2 2NH3已達到平衡狀態的是
2NH3已達到平衡狀態的是
①一個N≡N斷裂的同時,有3個H-H鍵斷裂;②一個N≡N鍵斷裂的同時,有6個N-H鍵斷裂;③其它條件不變時,混合氣體平均相對分子質量不再改變;④保持其它條件不變時,體系壓強不再改變;⑤NH3、N2、H2的體積分數都不再改變;⑥恒溫恒容時,混合氣體的密度保持不變;⑦正反應速率v(H2) = 0.6 mol/(L·min),逆反應速率v(NH3) = 0.4 mol/(L·min)
| A.全部 | B.①③④⑤ | C.②③④⑤⑦ | D.③⑤⑥⑦ |
C
解析試題分析:反應到達平衡狀態時,正逆反應速率相等,平衡時各物質的濃度、百分含量不變,可以及由此衍生的一些量也不發生變化,由此進行判斷。解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態。①無論是否達到平衡狀態,只要一個N≡N斷裂的同時,就有3個H-H鍵斷裂,所以不能證明該反應達到平衡狀態,故錯誤;②反應達到平衡狀態時,只要一個N≡N鍵斷裂的同時,就有有6個N-H鍵斷裂,所以能證明該反應達到平衡狀態,故正確;③該反應達到平衡狀態時,氣體總物質的量不變,氣體混合物的質量不變,所以其他條件不變時,混合氣體平均相對分子質量不再改變,能說明該反應達到平衡狀態,故正確;④該反應是一個氣體體積改變的反應,當反應達到平衡狀態時,各物質的濃度不變,則其壓強也不變,所以保持其他條件不變時,體系壓強不再改變,能說明該反應達到平衡狀態,故正確;⑤反應達到平衡狀態時,各物質的百分含量不變,所以NH3%、N2%、H2%都不再改變能證明說明該反應達到平衡狀態,故正確;⑥恒溫恒容時,密度始終保持不變,所以不能證明該反應達到平衡狀態,故錯誤;⑦v正(H2)表示消耗H2的速率,v逆(NH3)表示消耗NH3的速率,且v正(H2):v逆(NH3)=3:2,充分說明向兩個相反方向進行的程度相當,說明到達平衡狀態,故正確;故選C。
考點:考查考查化學平衡狀態的判斷


 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:單選題
將等物質的量的N2、H2氣體充入某密閉容器中,在一定條件下,發生如下反應并達到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。當改變某個條件并維持新條件直至新的平衡時,下表中關于新平衡與原平衡的比較正確的是
2NH3 (g);△H<0。當改變某個條件并維持新條件直至新的平衡時,下表中關于新平衡與原平衡的比較正確的是
| | 改變條件 | 新平衡與原平衡比較 |
| A | 增大壓強 | N2的濃度一定變小 |
| B | 升高溫度 | N2的轉化率變小 |
| C | 充入一定量H2 | H2的轉化率不變,N2的轉化率變大 |
| D | 使用適當催化劑 | NH3的體積分數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
高爐煉鐵過程中發生的反應: Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
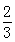 Fe(s)+CO2(g),已知該反應在不同溫度下的平衡常數如下表,下列說法不正確的是( )
Fe(s)+CO2(g),已知該反應在不同溫度下的平衡常數如下表,下列說法不正確的是( )
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
反應C(s)+H2O(g)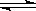 CO(g)+ H2(g)在一容積可變的密閉容器中進行。下列條件的改變對其反應速率幾乎無影響的是
CO(g)+ H2(g)在一容積可變的密閉容器中進行。下列條件的改變對其反應速率幾乎無影響的是
| A.壓縮容器體積,增大體系壓強 |
| B.加入適當的催化劑 |
| C.保持壓強不變,充入惰性氣體使容器容積增大 |
| D.保持容器容積不變,充入惰性氣體使體系壓強增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在恒溫條件下,將氣體X、Y充入2 L密閉容器中反應生成氣體Z。若各氣體的物質的量隨時間變化曲線如圖所示,下列描述正確的是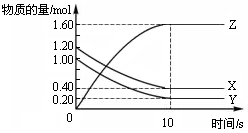
| A.前10s內 v(X)=0.08mol·L-1·s-1 |
| B.該反應的平衡常數K= 4 |
| C.平衡時X、Y的轉化率相同 |
| D.達到平衡后,將容器體積擴大為 4 L,平衡向逆反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定條件下存在反應:A(g)+B(g) C(g)+D(g) ΔH<0。現有三個相同的2 L恒容絕熱(與外界沒有熱量交換)密閉容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃條件下開始反應。達到平衡時,下列說法正確的是
C(g)+D(g) ΔH<0。現有三個相同的2 L恒容絕熱(與外界沒有熱量交換)密閉容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃條件下開始反應。達到平衡時,下列說法正確的是
| A.容器Ⅰ、Ⅱ中正反應速率相同 |
| B.容器Ⅰ、Ⅲ中反應的平衡常數相同 |
| C.容器Ⅰ中A的物質的量比容器Ⅱ中的多 |
| D.容器Ⅰ中A的轉化率與容器Ⅱ中C的轉化率之和小于1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關說法正確的是
| A.實驗室制氫氣,為了加快反應速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.為處理鍋爐水垢中的CaSO4,可先用飽和Na2CO3溶液浸泡,再加入鹽酸溶解 |
C.反應N2(g)+3H2(g) 2NH3(g)△H<0平衡時,其他條件不變,升高溫度,再次達到平衡時氫氣轉化率增大 2NH3(g)△H<0平衡時,其他條件不變,升高溫度,再次達到平衡時氫氣轉化率增大 |
D.吸熱反應“TiO2(s)+2Cl2(g) TiCl4(g)+O2(g)”在一定條件下可自發進行,則該反應的△S<0 TiCl4(g)+O2(g)”在一定條件下可自發進行,則該反應的△S<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一氧化碳是一種用途相當廣泛的化工基礎原料。利用下列反應可以將粗鎳轉化為純度達99.9%的高純鎳。Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密閉容器中,放入鎳粉并充入一定量的CO氣體,已知該反應的平衡常數如下表
| 溫度℃ | 25 | 80 | 230 |
| 平衡常數 | 5×10-4 | 2 | 1.9×10-5 |
 Ni(s)+4CO(g)的平衡常數是0.5
Ni(s)+4CO(g)的平衡常數是0.5查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某溫度時,在密閉容器中,X、Y、Z三種氣體濃度的變化如圖Ⅰ所示,若其它條件不變,當溫度分別為T1和T2時,Y的體積分數與時間關系如圖Ⅱ所示。則下列結論正確的是
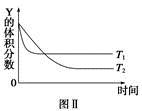
A.該反應的熱化學方程式為X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其它條件不變,升高溫度,正、逆反應速度均增大,X的轉化率減小 |
| C.達到平衡后,若其他條件不變,減小容器體積,平衡向逆反應方向移動 |
| D.達到平衡后,若其他條件不變,通入稀有氣體,平衡向正反應方向移動 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com