
【題目】草酸亞鐵(FeC2O4·2H2O)可用于制備磷酸鐵鋰電池正極材料。實驗室制備草酸亞鐵并測定其組成的實驗流程如下:

(1) “溶解”時加熱的目的是_____________________;“沉鐵”時將溶液煮沸并在不斷攪拌下加入H2C2O4溶液,“不斷攪拌”除可使反應物充分接觸外,另一目的是_____________________。
(2) “過濾、洗滌”時,能說明沉淀已洗滌干凈的依據是_____________________。
(3)按以下步驟可以測定產品中草酸根的質量分數。
①稱取0.1600g草酸亞鐵于錐形瓶中,加入25mL2mol·L-1的H2SO4溶液,加熱至40~50℃,使樣品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸約10min。
④將濾液過濾至另一個錐形瓶中,用10mL1mol·L-1的H2SO4溶液洗滌錐形瓶,將全部Fe2+轉移入錐形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液體積8.00 mL。
(I)測得的產品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)請計算產品中C2O![]() 的質量分數(寫出計算過程)。______________
的質量分數(寫出計算過程)。______________
【答案】 促進溶解 防止溶液暴沸 取少許最后一次洗滌過濾液,向其中加入BaCl2溶液(用pH試紙檢驗),若無白色沉淀產生(pH等于7),說明已洗滌干凈 > w(C2O42-) =![]() ×100%=43.45%
×100%=43.45%
【解析】(1)“溶解”時加熱的目的是加快反應速率,促進溶解;由于反應是加熱煮沸,所以“不斷攪拌”除可使反應物充分接觸外,另一目的是防止溶液暴沸。(2)沉淀表面含有硫酸根離子,所以 “過濾、洗滌”時,能說明沉淀已洗滌干凈的依據是取少許最后一次洗滌過濾液,向其中加入BaCl2溶液,若無白色沉淀產生,說明已洗滌干凈。(3)(I)根據方程式可知n(C2O42-)=![]() ×n(KMnO4)=
×n(KMnO4)=![]() ×[0.02000 mol·L-1×(23.80-8.00) mL×10-3L·mL-1]=7.900 ×10-4 mol,n(Fe2+)=5n(KMnO4)=5×0.02000 mol·L-1×8.00) mL×10-3L·mL-1=8.000 ×10-4 mol,所以測得的產品中n(Fe2+)∶n(C2O42-)>1∶1;(II)根據以上分析可知w(C2O42-)=
×[0.02000 mol·L-1×(23.80-8.00) mL×10-3L·mL-1]=7.900 ×10-4 mol,n(Fe2+)=5n(KMnO4)=5×0.02000 mol·L-1×8.00) mL×10-3L·mL-1=8.000 ×10-4 mol,所以測得的產品中n(Fe2+)∶n(C2O42-)>1∶1;(II)根據以上分析可知w(C2O42-)=![]() ×100%=43.45%。
×100%=43.45%。


 步步高達標卷系列答案
步步高達標卷系列答案科目:高中化學 來源: 題型:
【題目】有一類組成最簡單的有機硅化合物叫硅烷,它的分子結構與烷烴相似,下列有關說法錯誤的是
A.相同條件下,硅甲烷的密度小于甲烷
B.硅甲烷燃燒生成二氧化硅和水
C.硅烷的分子通式可表示為SinH2n+2
D.硅甲烷與硅乙烷的相對分了質量相差30
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某一固體物質可能由NaOH、AlCl3、MgCl2中的幾種組成,將其一定量溶于水,有沉淀產生,在所得懸濁液中逐滴加入5mol/L的鹽酸,右圖表示鹽酸加入量與沉淀量的變化關系,圖中M點表示已加入的鹽酸體積,則M點的體積是
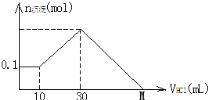
A. 70mL B. 130mL C. 120mL D. 100mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把V L含有MgSO4和K2SO4的混合溶液分成兩等份,一份加入含a mol NaOH的溶液,恰好使鎂離子完全沉淀為氫氧化鎂;另一份加入含b mol BaCl2的溶液,恰好使硫酸根離子完全沉淀為硫酸鋇,則原混合溶液中鉀離子物質的量濃度為( )
A. 2(2b-a)/V mol·L-1 B. (2b-a)/V mol·L-1 C. 2(b-a)/V mol·L-1 D. (b-a)/V mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用雙線橋法表示下列反應的電子轉移情況并將其改寫成離子方程式: 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,______________,離子方程式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含
硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含![]()
![]() 硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示為酸性介質中,金屬銅與氫疊氮酸(HN3) 構成的原電池,總反應方程式為: 2Cu+2Cl-+HN3+3H+=2CuCl(s)+N2↑+NH4+。下列敘述錯誤的是( )
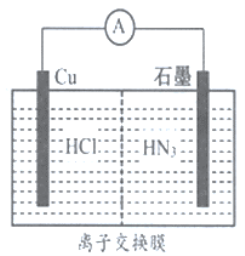
A. 離子交換膜為陽離子交換膜
B. 若將鹽酸換成NaCl,電池的運行效率將會下降
C. 負極的電極反應式為:Cu-e-=Cu+
D. 當外電路中流過0.1mol電子時,交換膜左側離子減少0.2mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列說法正確的是( )
A. 標準狀況下,以任意比例混合的氧氣和二氧化碳混合物22.4 L,所含的分子數為NA
B. 標準狀況下,1 L汽油(分子式為C8H18)完全燃燒后,所生成氣體產物的分子數為8NA/22.4
C. 標準狀況下,1 L SO3所含分子數為NA/22.4
D. 標準狀況下,以任意比混合的氫氣和一氧化碳氣體共8.96 L,在足量氧氣中充分燃燒時消耗氧氣的分子數為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化鋇有劇毒,致死量為0.3g,萬一不慎誤服,應大量吞服雞蛋清及適量解毒劑,此解毒劑是( )
A.AgNO3
B.CuSO4
C.MgSO4
D.Na2CO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com