
在一定條件下,反應x A+YB zC達到平衡:
zC達到平衡:
(1)若A、B、C均為氣體,則該反應的平衡常數表達式為_______________________;
(2)若A、B、C均為氣體,減壓后平衡向逆反應方向移動,則x、y、z間的關系是___________;
(3)已知C是氣體,且x+y=z,在增大壓強時,若平衡發生移動,則一定向________(填“正”或“逆”)反應方向移動
科目:高中化學 來源: 題型:填空題
煤化工中常需研究不同溫度下平衡常數、投料比及熱值等問題。已知:
CO(g)+H2O(g) H2(g)+CO2(g)平衡常數隨溫度的變化如下表:
H2(g)+CO2(g)平衡常數隨溫度的變化如下表:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),當反應達平衡時,CO的體積分數為X,若維持容器的體積和溫度不變,起始物質按下列四種配比充入該容器中,達到平衡時CO的體積分數不等于X的有
H2(g)+CO2(g),當反應達平衡時,CO的體積分數為X,若維持容器的體積和溫度不變,起始物質按下列四種配比充入該容器中,達到平衡時CO的體積分數不等于X的有 查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鋼鐵是21世紀用途最廣的結構材料和功能材料。其成分主要是Fe和少量C。
(1)工業上在煉鐵高爐中用CO熱還原Fe2O3冶煉鐵。寫出該反應的化學方程式并用單線橋表示電子轉移的方向和數目 。
(2)鐵鎂合金是目前已發現的儲氫密度最高的儲氫材料之一,其晶胞結構如圖(黑球代表Fe,白球代表Mg)。則鐵鎂合金的化學式為 。
(3)Fe3+的電子排布式為 ;CH3+微粒的中心原子雜化軌道類型為 ;
(4)向一定量的FeCl3溶液中加入適量KSCN溶液,溶液變紅色。該反應體系中存在化學平衡 (用反應式表示);向上述紅色溶液中加入Mg(OH)2固體,可觀察到溶液紅色變淺,有紅褐色沉淀析出。試用平衡移動原理解釋該現象 。(不考慮SCN—與Mg2+反應)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
根據反應:mA(g) + nB(g) pC(g) △H,結合圖中所給的信息填空。
pC(g) △H,結合圖中所給的信息填空。
(填“>”、“=”或“<”)
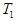 ______
______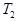
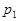 ______
______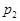
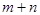 ______
______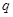
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一體積為10 L的容器中,通過一定量的CO和H2O,850 ℃時發生反應:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)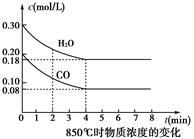
(1)CO和H2O濃度變化如圖,則0~4 min的平均反應速率v(CO)=______mol·L-1·min-1。
(2)如圖中4~5min之間該反應________(填“是”或“否”)處于平衡狀態,判斷理由________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(13分)近些年來,世界各地頻現種種極端天氣。二氧化碳、氮氧化物、二氧化硫等是導致極端天氣的重要因素,研究這些化合物的綜合處理具有重要意義。
(1)工業上可利用二氧化碳和氨氣合成尿素,其總反應如下:
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 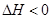 ,該反應在 (填“較高溫度”或“較低溫度”)下能自發進行。
,該反應在 (填“較高溫度”或“較低溫度”)下能自發進行。
(2)已知合成尿素分兩步進行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 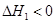
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 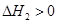
下列示意圖中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正確表示尿素合成過程中能量變化曲線的是(填序號) 。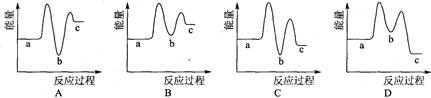
(3)合成尿素過程中,當NH3與CO2的物質的量之比為1:2時,NH3
的轉化率隨時間的變化關系如圖所示。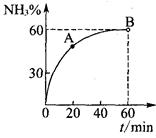
①A點的逆反應速率v逆(CO2) B點的逆反應速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②達到平衡時,CO2的轉化率為 。
(4)活性炭可用于處理大氣污染物NO,在某1L恒容密閉容器中加入 0.100molNO 和2.030mol固體活性炭(無雜質),生成氣體E和氣體F。當溫度分別在T1℃和T2℃時,測得平衡時各物質的物質的量如下表:
 物質 物質n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
工業上可以利用廢氣中的CO2為原料制取甲醇,其反應方程式為:CO2+3H2 CH3OH+H2O。請回答下列問題:
CH3OH+H2O。請回答下列問題:
(1)已知常溫常壓下下列反應的能量變化如下圖所示:
|
|
|
|

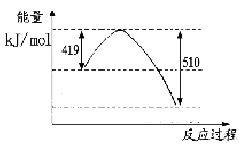 寫出由二氧化碳和氫氣制備甲醇的熱化學方程式__ _。
寫出由二氧化碳和氫氣制備甲醇的熱化學方程式__ _。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
【化學與技術】
工業上以氨氣為原料制備硝酸的過程如圖1所示:
某課外小組模擬上述部分過程設計了如圖2所示實驗裝置制備硝酸(所有橡膠制品均已被保護)
(1)工業上用氨氣制取NO的化學方程式是 ;
(2)連接好裝置后,首先進行的操作是 ;
(3)通入a氣體的目的是 ;
(4)盛有Na2CO3溶液的燒杯為尾氣處理裝置,該裝置中發生反應的化學方程式是 。
(5)已知:溫度低于21.15℃時,NO2幾乎全部轉變為N2O4,工業上可用N2O4與水反應來提高硝酸產率,N2O4與a氣體在冷水中生成硝酸的化學方程式是 ;
(6)一定條件下,某密閉容器中N2O4和NO2的混合氣體達到平衡時,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.則2NO2(g) N2O4(g)的平衡常數K= ,若NO2起始濃度為2mol/L,相同條件下,NO2的最大轉化率為 。
N2O4(g)的平衡常數K= ,若NO2起始濃度為2mol/L,相同條件下,NO2的最大轉化率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
在恒溫時,向某密閉容器中通入2mol X和1mol Y氣體,發生如下反應:
2X(氣)+Y(氣)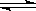 2Z(氣),壓強一定時,測得在平衡時Z的體積分數為0.4。
2Z(氣),壓強一定時,測得在平衡時Z的體積分數為0.4。
(1)與上述平衡保持同溫、同壓,若向密閉容器中通入4mol X(氣)、2mol Y(氣),達到平衡,則Z的體積分數為 ;平衡時,氣體的總物質的量是 。
(2)若向密閉器中通入X(氣)和Y(氣)的物質的量分別記為n(X)、n(Y),保持容器容積不變,并滿足平衡時Z的體積分數為0.4,則n(X)/n(Y)的取值范圍為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com