
【題目】以下說法正確的是
A.乙酸的分子式為 C2H4OB.C6H6 一定是苯
C.羥基可表示為—OHD.醛基可表示為—COH
 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源: 題型:
【題目】研究化學反應原理對于生產、生活及環境保護具有重要意義。請回答下列問題:
(1)常溫下,物質的量濃度均為0.1mol/L的四種溶液:①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3,pH從大到小排列順序為__________(填序號)。
(2)苯乙烯是工業上合成樹脂、離子交換樹脂及合成橡膠等的重要單體,工業上可用乙苯催化脫氫方法制備苯乙烯:
![]() 。
。
①已知乙苯(g)、苯乙烯(g)的燃燒熱分別為akJ/mol,bkJ/mol,則氫氣的燃燒熱為___kJ/mol(用含有Q、a、b的表達式表示,其中Q、a、b均大于0)。
②在實際生產中,在恒壓條件下常以高溫水蒸氣作為反應體系的稀釋劑(水蒸氣不參加反應),此時乙苯的平衡轉化率與水蒸氣的用量、壓強(p)的關系如下圖所示。

Ⅰ.加入水蒸氣稀釋劑能提高乙苯轉化率的原因是__________
Ⅱ.用平衡分壓代替平衡濃度計算平衡常數(Kp),其中,分壓=總壓×物質的量分數,則900K時的平衡常數Kp=________.
Ⅲ.改變下列條件,能使乙苯的反應速率和轉化率一定增大的是_______ (填字母)。
A.恒容時加入稀釋劑水蒸氣
B.壓強不變下,溫度升至1500K
C.在容積和溫度不變下充入Ar
D.選用催化效果更好的催化劑
(3)利用“Na-CO2”電池將CO2變廢為寶。我國科研人員研制出的可充電“Na-CO2”電池,以鈉箔和多壁碳納米管(MWCNT)為電極材料,總反應為4Na+3CO2![]() 2Na2CO3+C。放電時該電池“吸入”CO2,其工作原理如圖所示:
2Na2CO3+C。放電時該電池“吸入”CO2,其工作原理如圖所示:
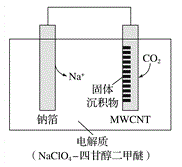
①放電時,正極的電極反應式為___________。
②若生成的Na2CO3和C全部沉積在電極表面,當轉移0.2mol 電子時,兩極的質量差為______g。(假設放電前兩電極質量相等)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 若H2O2分解產生1molO2,理論上轉移的電子數約為4×6.02×1023
B. 室溫下,pH=3的CH3COOH溶液與pH=11的NaOH溶液等體積混合,溶液pH>7
C. 鋼鐵水閘可用犧牲陽極或外加電流的陰極保護法防止其腐蝕
D. 一定條件下反應N2+3H22NH3達到平衡時,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物質的量的關系如圖所示,則下列說法錯誤的是
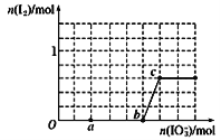
A. a點時NaHSO3過量
B. b點時還原產物為I-
C. b點到c點,KIO3與NaHSO3反應生成I2
D. 加入的KIO3為0.4mol或1.12mol時,I-均為0.4mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅(CuCl)常用作有機合成工業中的催化劑,在潮濕空氣中易水解氧化;見光則分解,變成褐色;CuCl難溶于醇和水,可溶于氯離子濃度較大的體系。下圖是工業上用制作印刷電路的廢液(含Fe3+、Cu2+、Fe2+、Cl-)
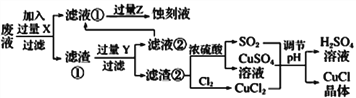
根據以上信息回答下列問題:
(1)寫出生產過程中所用物質的名稱:____________,________________。
(2)寫出產生CuCl的化學方程式:________________________________。
(3)在CuCl的生成過程中理論上不需要補充SO2氣體,結合化學方程式和必要的文字說明理由________________________________________________。實際生產中SO2要適當過量,原因可能是___(答一點即可).
(4)得到CuC1晶體后,還需要經過水洗、乙醇洗滌兩步操作。用乙醇洗滌的作用是________________。
(5)實驗探究pH對CuCl產率的影響如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl產率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶體最佳pH為_________,當pH較大時CuCl產率變低原因是________________。
(6)氯化亞銅的定量分析:
①稱取樣品0.25g和過量的FeCl3溶液于250mL錐形瓶中,充分溶解。
②用0.10molL-1硫酸鈰標準溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行實驗結果如下(平行實驗結果相差不能超過1%):
平行實驗次數 | 1 | 2 | 3 |
0.25g樣品消耗硫酸鈰標準溶液的體積(mL) | 24.35 | 24.05 | 23.95 | /tr>
則樣品中CuCl的純度為_______________(結果保留三位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1鹽酸,溶液的pH與所加鹽酸體積的關系如下圖所示(不考慮揮發)。下列說法正確的是

A. 點①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 點②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 點③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整個過程中可能出現:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于SO2的敘述,正確的是( )
A.SO2既可以是含硫物質的氧化產物,又可以是含硫物質的還原產物
B.SO2是硫在空氣中不完全燃燒的產物,SO3是硫在空氣中完全燃燒的產物
C.大氣中SO2的主要來源是汽車排出的尾氣
D.SO2具有漂白性,因而可以使石蕊試液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,在體積相等的三個恒容密閉容器中發生可逆反應:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。實驗測得起始、平衡時的有關數據如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。實驗測得起始、平衡時的有關數據如下表:
容器編號 | 起始時各物質物 質 的量 /mol | 平衡時反應中的能量變化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收熱量akJ |
② | 0 | 2 | 1 | 放出熱 量 bkJ |
③ | 4 | 0 | 0 | 吸收熱量ckJ |
下列敘述正確的是( )
A. 達平衡時O2的體積分數:①>③
B. 熱量關系:a一定等于b
C. ①②③ 反應的平衡常數:③>①>②
D. ①中的密度不再改變時說明反應已達到平衡狀態
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com