
將a L NH3通入某恒壓的密閉容器中,在一定條件下讓其分解,達到平衡后氣體體積增大到b L(氣體體積在相同條件下測定)。下列說法中正確的是( )
A.平衡后氨氣的分解率為 ×100% ×100% |
B.平衡混合氣體中H2的體積分數為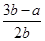 ×100% ×100% |
C.反應前后氣體的密度比為 |
D.平衡后氣體的平均摩爾質量為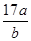 g g |
 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案科目:高中化學 來源: 題型:單選題
反應mA(g)+ nB(g)  pC(g)+qD(g),經5min后達到平衡,測得此時A的濃度減少了a mol/L,同時C的濃度增加了2a/3 mol/L,又測得平均反應速率v(C)=2v(B)。達到平衡后,若保持溫度不變,給體系加壓,平衡不移動,那么該反應可表示為( )
pC(g)+qD(g),經5min后達到平衡,測得此時A的濃度減少了a mol/L,同時C的濃度增加了2a/3 mol/L,又測得平均反應速率v(C)=2v(B)。達到平衡后,若保持溫度不變,給體系加壓,平衡不移動,那么該反應可表示為( )
A.2A(g)+ 6B(g) 3C(g)+5D(g)
3C(g)+5D(g)
B.3A(g)+ B(g) 2C(g)+2D(g)
2C(g)+2D(g)
C.3A(g)+ B(g)  2C(g)+ D(g)
2C(g)+ D(g)
D.A(g)+ 3B(g) 2C(g)+2D(g)
2C(g)+2D(g)
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
對于2SO2+O2 2SO3的反應,下列敘述中正確的是( )
2SO3的反應,下列敘述中正確的是( )
| A.“高溫”和“催化劑”的條件使SO2和O2產生了可發生性 |
| B.“高溫”和“催化劑”的條件可加快SO3分解為SO2和O2 |
| C.在該反應的平衡狀態,SO2、SO2、O2的濃度一定都相等 |
| D.在該反應的平衡狀態,正反應速率和逆反應速率相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
利用反應:2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH ="+746.8" kJ·mol-1,可凈化汽車尾氣,如果要同時提高該反應的速率和NO的轉化率,采取的措施是 ( )
2CO2(g)+N2(g) ΔH ="+746.8" kJ·mol-1,可凈化汽車尾氣,如果要同時提高該反應的速率和NO的轉化率,采取的措施是 ( )
| A.降低溫度 |
| B.增大壓強同時加催化劑 |
| C.升高溫度同時充入N2 |
| D.及時將CO2和N2從反應體系中移走 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將E和F加入密閉容器中,在一定條件下發生反應:E(g)+F(s)  2G(g)。忽略固體體積,平衡時G的體積分數(%)隨溫度和壓強的變化如下表所示:
2G(g)。忽略固體體積,平衡時G的體積分數(%)隨溫度和壓強的變化如下表所示:
| 壓強/MPa 體積分數/% 溫度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
為減小CO2對環境的影響,在倡導“低碳”的同時,還需加強對CO2創新利用的研究。T1℃時,將9 mol CO2和12 mol H2充入3 L密閉容器中,發生反應CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物質的量隨時間變化如曲線Ⅰ所示,平衡時容器內壓強為p1。改變某一條件重新進行上述反應,CH3OH的物質的量隨時間變化如曲線Ⅱ所示。下列說法錯誤的是( )
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物質的量隨時間變化如曲線Ⅰ所示,平衡時容器內壓強為p1。改變某一條件重新進行上述反應,CH3OH的物質的量隨時間變化如曲線Ⅱ所示。下列說法錯誤的是( )
| A.曲線Ⅱ對應的條件改變是增大壓強 |
| B.T2℃時,上述反應平衡常數為0.42,則T2>T1 |
| C.在T1℃,若起始時向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),則達平衡前v(正)>v(逆) |
D.在T1℃,若起始時向容器充入4.5 mol CO2、6 mol H2,平衡時容器內壓強p= |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在某恒容的密閉容器中,可逆反應A(g)+B(g) xC(g)有如圖所示的關系曲線,下列說法正確的是( )
xC(g)有如圖所示的關系曲線,下列說法正確的是( )
| A.溫度:T1>T2 | B.壓強:p1>p2 |
| C.正反應是吸熱反應 | D.x的值是2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
碘單質難溶于水卻易溶于KI溶液。碘水中加入KI溶液發生反應:I2(aq)+I-(aq) I3—(aq),該反應的平衡常數與溫度的關系如圖,下列說法不正確的是( )
I3—(aq),該反應的平衡常數與溫度的關系如圖,下列說法不正確的是( )
| A.上述正反應為放熱反應 |
| B.上述體系中加入苯,平衡不移動 |
| C.可運用該反應原理除去硫粉中少量的碘單質 |
| D.實驗室配制碘水時,為增大碘單質的溶解度可加入適量KI溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com