
【題目】在實驗室中用二氧化錳跟濃鹽酸反應制備干燥純凈的氯氣。進行此實驗,所用儀器如下圖:
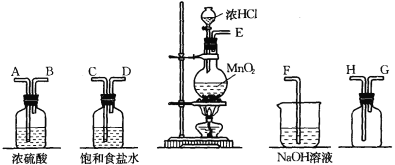
(1)連接上述儀器的正確順序是(填各接口處的字母):
接 ,____ 接 ,___ 接 , 接 。
(2)化學實驗中檢驗是否有Cl2產生常用濕潤的淀粉-KI試紙。如果有Cl2產生,可觀察到的現象是 。寫出該反應的化學反應方程式 。
(3)寫出下列化學反應的離子方程式:
①氣體發生裝置中進行的反應:_________________________;
②尾氣吸收裝置中進行的反應: 。
【答案】
(1)E 接 C , D接 A , B接 H , G 接 F 。
(2)試紙變藍色; 2KI+Cl2=2KCl+I2
(3)①MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,②Cl2+2OH—=Cl—+ClO—+H2O
Mn2++Cl2↑+2H2O,②Cl2+2OH—=Cl—+ClO—+H2O
【解析】
試題分析:(1)應用濃鹽酸以揮發形成的氯氣中含有氯化氫以及水蒸氣,首先利用飽和食鹽水出去氯化氫,利用濃硫酸干燥氯氣,氯氣的密度大于空氣,利用向上排空氣法收集收集,最后進行尾氣處理,所以正確的連接順序為E 接 C,D接A,B接H,G接F;
(2)氯氣具有強氧化性,能把碘化鉀氧化為單質碘,碘遇淀粉顯藍色,所以觀察到的實驗現象是試紙變藍色,反應的化學方程式為2KI+Cl2=2KCl+I2。
(3)①實驗室制備氯氣的離子方程式為MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
②尾氣用氫氧化鈉溶液吸收,反應的離子方程式為Cl2+2OH—=Cl—+ClO—+H2O。


 孟建平小學滾動測試系列答案
孟建平小學滾動測試系列答案科目:高中化學 來源: 題型:
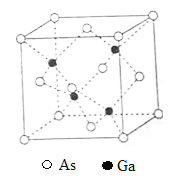
【題目】[化學——選修3:物質結構與性質]砷化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。回答下列問題:
(1)寫出基態As原子的核外電子排布式________________________。
(2)根據元素周期律,原子半徑Ga_____________As,第一電離能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立體構型為____________________,其中As的雜化軌道類型為_________。
(4)GaF3的熔點高于1000℃,GaCl3的熔點為77.9℃,其原因是_____________________。
(5)GaAs的熔點為1238℃,密度為ρg·cm-3,其晶胞結構如圖所示。該晶體的類型為________________,Ga與As以________鍵鍵合。Ga和As的摩爾質量分別為MGa g·mol-1和MAs g·mol-1,原子半徑分別為rGa pm和rAs pm,阿伏加德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法不正確的是
A.蔗糖水解生成互為同分異構體的葡萄糖和果糖
B.用灼燒的方法可以區分蠶絲和人造纖維
C.C4H9Cl有4種同分異構體
D.油脂和蛋白質都屬于高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作環保型阻燃材料,受熱時按如下化學方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)寫出該化合物作阻燃劑的兩條依據____________。
(2)用離子方程式表示除去固體產物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化學方程式表示其原理____________。
Ⅱ.磁性材料A是由兩種元素組成的化合物,某研究小組按如圖流程探究其組成:
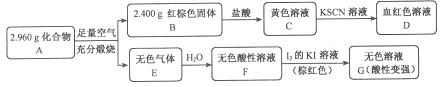
請回答:
(1)A的組成元素為_________(用元素符號表示),化學式為______。
(2)溶液C可溶解銅片,例舉該反應的一個實際應用____________。
(3)已知化合物A能與稀硫酸反應,生成一種淡黃色不溶物和一種氣體(標況下的密度為1.518 g·L-1),該氣體分子的電子式為____。寫出該反應的離子方程式__________。
(4)寫出F→G反應的化學方程式_____________。設計實驗方案探究溶液G中的主要微粒(不考慮H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼鐵生銹過程發生如下反應:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列說法正確的是
A. 反應①、②中電子轉移數目相等
B. 反應①中氧化劑是氧氣和水
C. 與銅質水龍頭連接處的鋼質水管不易發生腐蝕
D. 鋼鐵在潮濕的空氣中不能發生電化學腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知W、X、Y、Z為短周期元素,原子序數依次增大。W、Z同主族,X、Y、Z同周期,其中只有X為金屬元素。下列說法一定正確的是
A. 原子半徑:X>Y>Z>W
B. W的含氧酸的酸性比Z的含氧酸的酸性強
C. W的氣態氫化物的穩定性小于Y的氣態氫化物的穩定性
D. 若W與X原子序數差為5,則形成化合物的化學式為X3W2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國政府為了消除碘缺乏病,規定在食鹽中必須加入適量的碘酸鉀。檢驗食鹽中是否加碘,可利用如下反應:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)該反應的離子方程式為 。
(2)用“雙線橋”表示出反應中電子轉移的方向和數目:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(3)氧化產物與還原產物的質量之比為 。
(4)如果反應中轉移0.2mol電子,則生成I2的物質的量為_________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCN超標的電鍍廢水可用兩段氧化法處理:
(1)NaCN與NaClO反應,生成NaOCN和NaCl
(2)NaOCN與NaClO反應,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有劇毒;HCN、HOCN中N元素的化合價相同。
完成下列填空:
(1)第一次氧化時,溶液的pH應調節為____________(選填“酸性”、“堿性”或“中性”);原因是______________________。
(2)寫出第二次氧化時發生反應的離子方程式。
_______________________________________
(3)處理100 m3含NaCN 10.3 mg/L的廢水,實際至少需NaClO___g(實際用量應為理論值的4倍),才能使NaCN含量低于0.5 mg/L,達到排放標準。
(4)(CN)2與Cl2的化學性質相似。(CN)2與NaOH溶液反應生成_________、__________和H2O。
(5)上述反應涉及到的元素中,氯原子核外電子能量最高的電子亞層是___________;H、C、N、O、Na的原子半徑從小到大的順序為_______。
(6)HCN是直線型分子,HCN是___________分子(選填“極性”、“非極性”)。HClO的電子式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個容積固定為2L的密閉容器中,發生反應aA(g)+bB(g)![]() pC(g)△H=?。反應情況記錄如下表:
pC(g)△H=?。反應情況記錄如下表:

請仔細分析,根據表中數據回答下列問題:
(1)a= ____________,b= _______________, p=_____________。
(2)第2min到第4min內A的平均反應速率v(A)= _________ molL-1min-1。
(3)由表中數據可知反應在第4min到第6min時處于平衡狀態,若在第2min、第6min、第8min時分別改變了某一反應條件,則改變的條件分別可能是:
①第2min:___________ ______或_____________;
②第6min ________________________;
③第8min _______________________ ;
(4)若從開始到第4min建立平衡時反應放出的熱量為235.92kJ,則該反應的△H=____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com