
【題目】向100mL NaOH溶液中通入一定量的CO2氣體,充分反應后,再向所得溶液中逐滴加入0.2mol/L的鹽酸,產生CO2的體積與所加鹽酸體積之間關系如圖所示.下列判斷正確的是( ) 
A.原NaOH溶液的濃度為0.1mol/L
B.通入CO2的體積為448mL
C.所得溶液的溶質成分的物質的量之比為(NaOH):(Na2CO3)=1:3
D.所得溶液的溶質成分的物質的量之比為(NaHCO3):(Na2CO3)=2:1
【答案】D
【解析】解:A 根據化學反應,向100mL NaOH溶液中通入一定量的CO2氣體,可能發生的反應有:2NaOH+CO2═Na2CO3+H2O或NaOH+CO2═NaHCO3兩種可能的情況,再加入鹽酸,將Na2CO3或NaHCO3全部反應生成NaCl,根據化學反應中原子守恒,則有n(Na+)=n(Cl﹣),所以n(NaOH)=n(HCl)=0.2mol/L×0.1L=0.02mol,既得c(NaOH)=0.2mol/L,故A錯; B 根據題中的圖象,加鹽酸25mL是與Na2CO3反應,在加鹽酸到100mL是與NaHCO3的反應,設溶液中有Na2CO3 xmol,生成NaHCO3 mmol
Na2CO3 + | HCl ═ | NaHCO3+NaCl |
1mol | 1mol | 1mol |
x | 0.025L×0.2mol/L | mmol |
解得:x=0.005mol,m=0.005mol
設75mL鹽酸反應的NaHCO3的物質的量ymol,生成zmolCO2 , 則有
NaHCO3+ | HCl ═ | CO2↑+NaCl |
1mol | 1mol | 1mol |
ymol | 0.075L×0.2mol/L | zmol |
解得:y=0.015mol,z=0.015mol
根據原子守恒,加入鹽酸恰好完全反應時,共產生CO2 0.015mol,標準狀況下的體積為0.336L,故B錯;
C所得溶液的溶質成分為Na2CO3、NaHCO3 , 沒有NaOH,故C錯誤;
D根據題中的圖象,加鹽酸25mL是與Na2CO3反應,在加鹽酸到100mL是與NaHCO3的反應,設溶液中有Na2CO3 xmol,生成 NaHCO3 mmol
Na2CO3 + | HCl ═ | NaHCO3+NaCl |
1mol | 1mol | 1mol |
x | 0.025L×0.2mol/L | mmol |
解得:x=0.005mol,m=0.005mol
設75mL鹽酸反應的NaHCO3的物質的量ymol,生成zmolCO2 , 則有
NaHCO3+ | HCl ═ | CO2↑+NaCl |
1mol | 1mol | 1mol |
ymol | 0.075L×0.2mol/L | zmol |
解得:y=0.015mol,z=0.015mol
求得通入CO2反應后,Na2CO3 、NaHCO3 的物質的量分別為0.005mol、0.01mol,既得
n( NaHCO3 ):n(Na2CO3)=2:1,故D正確.
故選:D.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】
(1)電子工業常用FeCl3溶液做腐蝕液制造印刷電路板。用FeCl3做腐蝕液與Cu反應的原理為:2FeCl3+Cu=2FeCl2+CuCl2將一定量鐵粉和銅粉的混合物放入等濃度的FeCl3和CuCl2的混合溶液中,可發生多個反應,其中首先發生反應的離子方程式為:。
(2)某校研究性學習小組用已生銹(Fe2O3)的廢鐵屑制作印刷電路板的腐蝕液(FeCl3溶液),并將刻蝕電路板后的廢液再生為FeCl3溶液循環使用。實驗流程如下: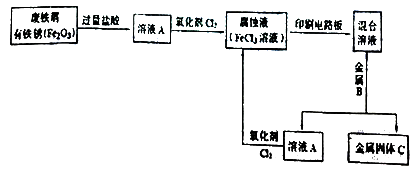
請根據使用流程寫出下列反應的離子方程式:
溶液A→腐蝕液:。
混合溶液+金屬B→金屬固體C:。
(3)檢驗腐蝕液中Fe3+存在的常用試劑是 , 證明Fe3+存在的現象是。
(4)取適量混合溶液于試管中,加入一定量的鐵粉,若反應結束后試管中仍有少量固體,則固體中一定含有 , 溶液中可能含有的金屬陽離子是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向200mL某物質的量濃度的NaOH溶液中緩慢通入一定量的CO2 , 充分反應,測得最后溶液的pH>7.
(1)此時溶液的溶質如果是單一成分,可能是;如果是多種成分,可能是 .
(2)在上述所得溶液中,逐滴緩慢滴加2molL﹣1的鹽酸,所得氣體(不考慮溶解于水)的體積與所加鹽酸的體積關系如圖所示:
①加入鹽酸200mL之前,無氣體產生,寫出OA段發生反應的離子方程式 .
②B點時,反應所得溶液中溶質的物質的量濃度是(溶液體積的變化忽略不計).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環扁桃酯是用于治療心腦血管疾病的重要化合物,它的一種合成路線如圖. 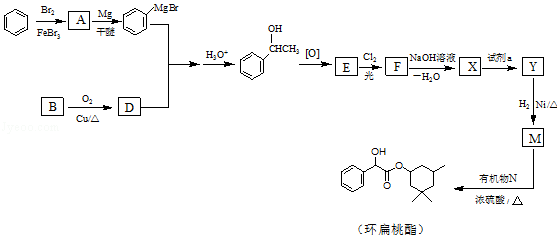
已知: 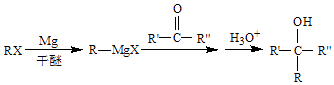 (R、R′、R″代表烴基或氫)
(R、R′、R″代表烴基或氫)
(1)A的結構簡式是 .
(2)B→D的化學方程式是 .
(3)紅外吸收光譜表明E有C=O鍵.F的分子式為C8H6Cl2O. ①E的結構簡式是 .
②E→F的反應類型是 .
(4)X的結構簡式是 .
(5)試劑a是 .
(6)生成環扁桃酯的化學方程式是 .
(7)以CH3CH=CH2、CH3CHO為有機原料,結合題目所給信息,選用必要的無機試劑合成CH2=CHCH=CHCH3 , 寫出合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列措施中,不能提高化學反應速率的是
A. Zn與稀硫酸的反應中,用Zn片代替Zn粉
B. KC103的分解反應中,適當提高反應溫度
C. H202的分解反應中,添加適量MnO2
D. 合成氨的反應中,增大體系的總壓力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是一些常見單質、化合物之間的轉化關系圖,有些反應中的部分物質被略去.常溫常壓下,A為無色有毒氣體,B為紅棕色粉末,C,E為金屬單質,G,J的焰色均為黃色.反應①為煉鐵高爐中的重要反應;反應②可用于焊接鐵軌. 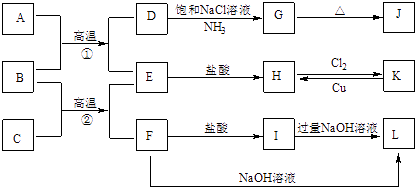
請回答下列問題:
(1)B的化學式為 , J的化學式為 .
(2)工業上將氯氣通入石灰乳中制取漂白粉,該反應的化學反應方程式為 .
(3)D→G是侯氏制堿法的主要反應,該反應的化學方程式為 .
(4)K→H是制作印刷電路板的重要反應,該反應的離子方程式為 .
(5)F→L是鋁土礦提純中的重要反應,該反應的離子方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下有可逆反應:A(g)+2B(g)2C(g)+D(g).現將5mol A和10mol B加入一體積為2L的密閉容器中,反應至10min時改變某一條件,C的物質的量濃度隨時間變化關系如圖所示.下列有關說法正確的是( ) 
A.在0~5min內,正反應速率逐漸增大
B.反應從起始至5min時,B的轉化率為50%
C.5min時的平衡常數與10min時的平衡常數不等
D.第15min時,B的體積分數為25%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A是生產生活中用量最大的金屬,B為淡黃色粉末。在常溫下C為無色液體,E、G、H、I、J為氣體,其中H為黃綠色,其它為無色.J能使濕潤的紅色石蕊試紙變藍(圖中部分產物已略去)。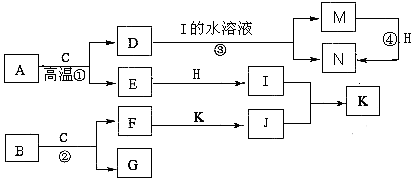
請填寫下列空白
(1)寫出化學式:M , K。
(2)寫出①的化學方程式;寫出③的離子方程式。
(3)反應④屬于下列何種反應類型______(填字母序號)。
A.化合反應
B.氧化還原反應
C.離子反應
D.置換反應
(4)若要確定③反應后所得溶液中含有M物質,所選試劑為______(填序號)。
A.KSCN溶液和氯水
B.鐵粉和KSCN
C.濃氨水
D.酸性高錳酸鉀溶液
(5)常溫下,H與過量的J反應產生濃厚的白煙,另一生成物是空氣的主要成分之一,請寫出該反應的化學方程式。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關圖示分析正確的是( ) 
A.如圖a所示,集氣瓶內充滿Cl2和CH4的混合氣體或NO2和O2的混合氣體,置于光亮處,將滴管內的水擠入集氣瓶后,燒杯中的水會進入集氣瓶,并可能充滿集氣瓶
B.如圖b所示,X為鐵棒,Y為銅棒,a為直流電源,當S閉合后,當b為NaOH溶液,X極附近產生白色沉淀時,電子從X極流入a
C.Pt為電極,電解含0.10 mol M+和0.1 mol N3+(M+、N3+均為金屬陽離子)的溶液,陰極析出金屬單質或氣體的總物質的量(y)與導線中通過電子的物質的量(x)的關系如圖c,離子氧化能力M+>N3+>H+
D.圖d為N2(g)和O2(g)生成NO(g)過程中的能量變化,則N≡N的鍵能為946kJ/mol,熱化學方程式為:N2(g)+O2(g)=2NO(g)△H=﹣180 kJ/mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com