
【題目】在含1 mol復鹽NH4Al(SO4)2稀溶液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,則生成NH3·H2O的物質的量為( )
A. 0 mol B. 0.2mol C. l mol D. 0.4mol
 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南大學出版社系列答案
同步練習西南大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案科目:高中化學 來源: 題型:
【題目】有機物H是一種合成藥物的中間體,H的合成方案如下:

已知: ![]()
請回答下列問題:
(1)A為相對分子質量為104的芳香烴,A的實驗式為___________
(2)可鑒別A和C兩種有機物的試劑為(答出一種即可)___________________________
(3)F為一氯代物,其核磁共振氫譜有三個吸收峰,則E的結構簡式為________________
(4)寫出B→C的化學方程式____________________________________________________
(5)寫出D和G生成H的化學方程式_____________________________________________
(6)D的同分異構體中能與FeCl3溶液發生顯色反應且能發生銀鏡反應的有__________種,寫出其中核磁共振氫譜中吸收峰數目最少的結構簡式__________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含Fe2+、I-、Br-的溶液中通入過量的氯氣,溶液中四種粒子的物質的量變化如圖所示,已知:b-a=5,線段Ⅳ表示一種含氧酸,且Ⅰ和Ⅳ表示的物質中含有相同的元素。下列說法不正確的是

A. 線段Ⅱ表示Fe2+的變化情況
B. 線段Ⅳ發生反應的離子方程式為:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根據圖象可計算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.如圖所示,甲、乙之間的隔板K和活塞F都可左右移動,甲中充入2molA和1molB,乙中充入2molC和1molHe,此時K停在0處。在一定條件下發生可逆反應:2A(g)+B(g)![]() 2C(g);反應達到平衡后,再恢復至原溫度。回答下列問題:
2C(g);反應達到平衡后,再恢復至原溫度。回答下列問題:
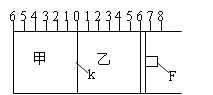
(1)可根據 _______________現象來判斷甲乙都已達到平衡狀態。
(2)達到平衡時,隔板K最終停留在0刻度左側a處,則a的取值范圍是___________________。
(3)若達到平衡時,隔板K最終停留在左側刻度1處,此時甲容積為2L,反應化學平衡常數為______________(帶單位)
Ⅱ.若一開始就將K、F如圖固定,其他條件均不變,則達到平衡時:
(1)測得甲中A的轉化率為b,則乙中C的轉化率為 _________________ ;
(2)假設乙、甲兩容器中的壓強比用d表示,則d的取值范圍是 ____________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
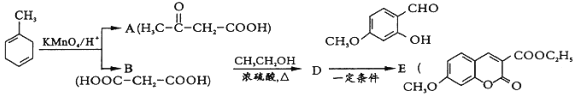
【題目】【題目】有機物E是醫藥合成中間體.其合成路線如圖:
(1)![]() 的官能團名稱為______.
的官能團名稱為______.
(2)已知![]() 的系統命名為 2-丙酮酸,則A的名稱是________________.
的系統命名為 2-丙酮酸,則A的名稱是________________.
(3)D為二元酯,則B→D的化學方程式為________________________________________.
D→E的反應歷程如圖:

(4)寫出這幾步的反應類型:I_____________,Ⅱ____________III____________
(5)![]() 中能與稀 NaOH溶液反應的官能團是______.檢驗該官能團的方法是__________________________________________.
中能與稀 NaOH溶液反應的官能團是______.檢驗該官能團的方法是__________________________________________.
(6)寫出滿足下列條件的D的所有同分異構體的結構簡式______________________________.
a.核磁共振氫譜有3組峰
b.常溫下能與NaHCO3按1:2反應并釋放出氣體
(7)由化合物A經過兩步便可以合成環境友好型高聚物聚3-羥基丁酸酯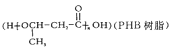
請寫出反應合成線路,結合已知信息選用必要的無機試劑,用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈦(Ti)的機械強度高,抗蝕能力強,有“未來金屬”之稱。工業上常用硫酸浸鈦鐵礦(其主要成分為鈦酸亞鐵(FeTiO 3它難溶于水,但能與酸反應)的方法制取二氧化鈦 ,再由二氧化鈦 制取金屬鈦。工藝流程如下:

回答下列問題
(1) FeTiO3中鈦元素的化合價為____。
(2)稀硫酸與FeTiO3反應的離子方程式為:____。
(3)過程V表現了金屬鎂的還原性比金屬鈦的還原性____(填“強”或“弱”)。
(4)寫出過程IV的化學方程式____(注意焦炭過量)。
(5)酸浸中,鐵的浸出率與時間、溫度的關系如圖所示,如圖可知,當鐵的浸出率為70%時,可采用的實驗條件為____。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com