
【題目】KClO3和KHSO3能發生反應:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知該反應的速率隨c(H+)的增大而加快。下圖為用ClO3-在單位時間內物質的量濃度變化表示的該反應υ-t圖。下列說法正確的
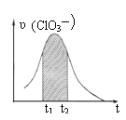
A. 反應開始時速率增大可能是c(H+)所致
B. 縱坐標為υ(Cl-)的υ-t曲線與圖中曲線不能完全重合
C. 后期速率υ下降的主要原因是反應向逆反應方向進行
D. 圖中陰影“面積”可以表示t1-t2時間內c(SO42-)增加量
【答案】A
【解析】
1molClO3-參加氧化還原反應得到6mol電子,1mol亞硫酸氫根離子參加氧化還原反應失去2mol電子,所以得失電子的最小公倍數是6,則ClO3-的計量數是1,亞硫酸氫根離子的計量數是3,由原子個數守恒可得反應方程式為ClO3-+3HSO3-=3SO42-+Cl-+3H+。
A項、由題給信息可知反應的速率隨c(H+)的增大而加快,由方程式可知,反應開始時隨著反應的進行,c(H+)不斷增大,反應的速率加快,故A正確;
B項、化學反應速率之比等于化學計量數之比,由方程式可知υ(ClO3-):υ(Cl-)=1:1,則縱坐標為υ(Cl-)的υ-t曲線與圖中曲線重合,故B錯誤;
C項、隨著反應的進行,反應物的濃度減少,反應速率減小,所以后期反應速率下降的主要原因是反應物濃度減小,故C錯誤;
D項、圖中陰影“面積”可以表示t1-t2時間內c(ClO3-)減少量,由方程式可知,SO42-的化學計量數是ClO3-的3倍,則t1-t2時間內c(SO42-)增加量應是c(ClO3-)減少量的3倍,故D錯誤;
故選A。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知25° C時,二元酸H2X的電離平衡常數K1=5.0×10-2,K2=5.4×10-5。此溫度下用AgNO3溶液分別滴定濃度均為0.01mol·L-1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡圖像如圖所示。下列敘述正確的是
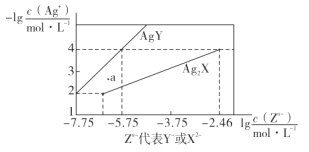
A.25°C時,KHX的溶液pH>7
B.反應Ag2X+2Y- 2AgY+ X2-的平衡常數為103.29
C.a點既可以表示AgY的不飽和溶液也可以表示Ag2X的過飽和溶液
D.向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液時,先生成AgY沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取軟錳礦石(主要成分為![]() )
)![]() 跟足量濃鹽酸發生如下反應(雜質不參與反應)
跟足量濃鹽酸發生如下反應(雜質不參與反應)![]() ,制得
,制得![]() (標準狀況)。下列有關說法中不正確的是( )
(標準狀況)。下列有關說法中不正確的是( )
A. 這種軟錳礦石中![]() 的質量分數為
的質量分數為![]()
B. 被氧化的![]() 的物質的量為
的物質的量為![]()
C. 參加反應的![]() 的質量為
的質量為![]()
D. 被還原的![]() 的物質的量為
的物質的量為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生為探究鈉與二氧化碳的反應,利用如圖裝置進行實驗。
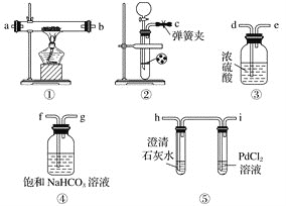
已知PdCl2能被一氧化碳還原得到黑色的Pd。請回答下列問題:
(1)請將上圖各裝置連接完整:c接f,______接______,______接______,______接______。
(2)若用稀鹽酸與碳酸鈣反應制備二氧化碳,在加稀鹽酸時,發現碳酸鈣與稀鹽酸不能接觸,而稀鹽酸又不夠了,為使反應能順利進行,可向長頸漏斗中加入的試劑是______(填字母)。
A.硝酸鈉溶液 B.四氯化碳 C.苯 D.稀硝酸
(3)檢查裝置氣密性并裝好藥品后,點燃酒精燈之前應進行的操作是打開彈簧夾,讓二氧化碳充滿整個裝置,當觀察到________________時,再點燃酒精燈。此步操作的目的是________________________________。
(4)反應過程中二氧化碳足量,假如反應過程中有下列兩種情況,分別寫出兩種情況下鈉與二氧化碳反應的化學方程式。
Ⅰ.裝置⑤PdCl2溶液中觀察到有黑色沉淀,裝置①中固體成分只有一種,且向固體中加入稀鹽酸產生能使澄清石灰水變渾濁的氣體: ___________________________。
Ⅱ.裝置①中鈉的質量為0.46 g,充分反應后,將裝置①中的固體加入到足量稀鹽酸中產生224 mL(標準狀況)二氧化碳氣體,且溶液中還有固體殘留:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)汽車尾氣中的 NO和CO可在催化劑作用下生成無污染的氣體而除去。在密閉容器中充入10 mol CO和8 mol NO發生反應,測得平衡時NO的體積分數與溫度、壓強的關系如圖。
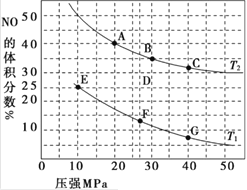
①已知該反應在較低溫度下能自發進行,則反應 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
②該反應達到平衡后,為同時提高反應速率和CO的轉化率,可采取的措施有______ (填字母序號)
a.改用高效催化劑 b.縮小容器的體積 c.增加 NO 的濃度 d.升高溫度
(2)在有氧條件下,新型催化劑M能催化NH3與NOx反應生成N2,將一定比例的O2、NH3 和NOx的混合氣體勻速通入裝有催化劑M的反應器中反應,反應相同時間,NOx的去除率隨反應溫度的變化曲線如圖所示。
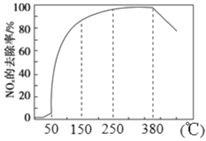
解釋在50 ℃~150 ℃范圍內隨溫度升高,NOx 的去除率迅速上升的原因是_______
(3)NH3催化還原氮氧化物技術是目前應用最廣泛的煙氣脫氮技術:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。密閉容器中,在相同時間內,在催化劑 A作用下脫氮率隨溫度變化如圖所示。
5N2(g)+6H2O(g) ΔH<0。密閉容器中,在相同時間內,在催化劑 A作用下脫氮率隨溫度變化如圖所示。
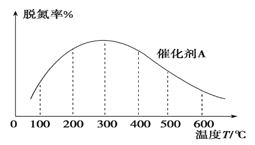
現改用催化能力稍弱的催化劑B進行實驗,請在上圖中畫出在催化劑 B作用下的脫氮率隨溫度變化的曲線_________(不考慮溫度對催化劑活性的影響)。
(4)某研究小組利用反應:C(s)+2NO(g)![]() N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得 NO的轉化率隨溫度的變化如圖所示:
N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得 NO的轉化率隨溫度的變化如圖所示:
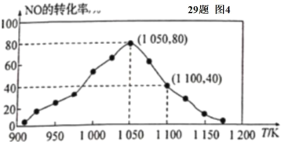
①由圖可知,在 1050 K 前,反應中 NO的轉化率隨溫度升髙而增大,其原因為____________; 在 1100 K 時,N2的體積分數為____________。
②用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(記作 Kp )。在 1050 K、1.1×106 Pa 時,該反應的化學平衡常數 Kp=____________(已知:氣體分壓(P分) =氣體總壓(Pa)×體積分數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以硫酸法鈦白粉生產中排放的含錳廢水(主要金屬離子為Mn2+、Fe2+、Al3+,還含有少量Ca2+、Mg2+、Cu2+和Ni2+等離子)為原料,生產MnCO3的工藝流程如下:
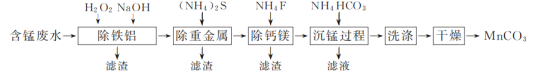
已知:25 ℃時,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含錳廢水經過前三步預處理,得到主要含有Mn2+的母液。
①除鐵鋁時,在攪拌條件下先加入H2O2溶液,再加入NaOH溶液調節pH。加入H2O2溶液時發生反應的離子方程式為__________________________________________。
②除鈣鎂步驟中,當Ca2+、Mg2+沉淀完全時,溶液中![]() =________。
=________。
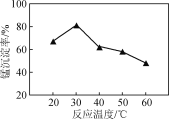
(2) 沉錳過程在pH為7.0條件下充分進行,反應溫度對錳沉淀率的影響關系如圖所示。
①沉錳過程發生反應的離子方程式為____________。該過程中加入適當過量的NH4HCO3的原因是________。
②當溫度超過30 ℃,沉錳反應的錳沉淀率隨溫度升高而下降的原因是______________________________。
(3) 沉錳后過濾得到MnCO3粗產品,依次用去離子水和無水乙醇各洗滌2~3次,再低溫干燥,得到純凈的MnCO3。用無水乙醇洗滌的目的是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為一定條件下采用多孔惰性電極的儲氫電池充電裝置(忽略其他有機物)。已知儲氫裝置的電流效率![]() ×100%,下列說法不正確的是
×100%,下列說法不正確的是
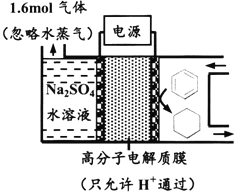
A. 采用多孔電極增大了接觸面積,可降低電池能量損失
B. 過程中通過C-H鍵的斷裂實現氫的儲存
C. 生成目標產物的電極反應式為C6H6+6e-+6H+===C6H12
D. 若![]() =75%,則參加反應的苯為0.8mol
=75%,則參加反應的苯為0.8mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的化學用語表達正確的是( )
A. 乙烯的結構簡式:CH2CH2 B. 羥基的電子式:![]()
C. 甲醇的球棍模型:![]() D. 乙酸的實驗式:CH3COOH
D. 乙酸的實驗式:CH3COOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1200℃時,天然氣脫硫工藝中會發生下列反應:
H2S(g)+3/2 O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2 O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g) △H4
則△H4的正確表達式為( )
A.△H4=3/2(△H1-△H2-3△H3)B.△H4=2/3 (3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)D.△H4=2/3 (△H1+△H2-3△H3)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com