
【題目】以硫酸法鈦白粉生產中排放的含錳廢水(主要金屬離子為Mn2+、Fe2+、Al3+,還含有少量Ca2+、Mg2+、Cu2+和Ni2+等離子)為原料,生產MnCO3的工藝流程如下:
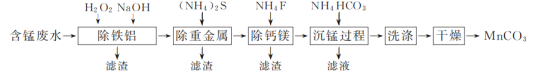
已知:25 ℃時,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含錳廢水經過前三步預處理,得到主要含有Mn2+的母液。
①除鐵鋁時,在攪拌條件下先加入H2O2溶液,再加入NaOH溶液調節pH。加入H2O2溶液時發生反應的離子方程式為__________________________________________。
②除鈣鎂步驟中,當Ca2+、Mg2+沉淀完全時,溶液中![]() =________。
=________。
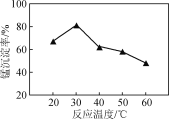
(2) 沉錳過程在pH為7.0條件下充分進行,反應溫度對錳沉淀率的影響關系如圖所示。
①沉錳過程發生反應的離子方程式為____________。該過程中加入適當過量的NH4HCO3的原因是________。
②當溫度超過30 ℃,沉錳反應的錳沉淀率隨溫度升高而下降的原因是______________________________。
(3) 沉錳后過濾得到MnCO3粗產品,依次用去離子水和無水乙醇各洗滌2~3次,再低溫干燥,得到純凈的MnCO3。用無水乙醇洗滌的目的是____________________________。
【答案】2Fe2++H2O2+2H+=2Fe3++2H2O 2 Mn2++2HCO3-=MnCO3↓+H2O+CO2↑ 提高Mn2+的沉淀率 溫度升高,NH4HCO3受熱分解(或Mn2+水解) 有利于低溫條件下快速干燥
【解析】
含錳廢水經過除鐵鋁時,鐵亞鐵離子被氧化成鐵離子,鐵離子和鋁離子轉化為氫氧化物沉淀,經過除重金屬時,銅離子和鎳離子轉化為硫化銅和硫化鎳沉淀,經過除鈣鎂時,鈣離子和鎂離子轉化為氟化鈣和氟化鎂沉淀,溶液中的錳離子在沉錳時轉化為碳酸錳沉淀,后經洗滌干燥得到純凈的碳酸錳。
(1)①加入H2O2溶液是將亞鐵離子氧化成鐵離子,便于轉化成沉淀除去,其反應的離子反應方程式為2Fe2++H2O2+2H+=2Fe3++2H2O,故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;
②鈣離子和鎂離子轉化為氟化鈣和氟化鎂沉淀,則溶液中![]() ,故答案為:2;
,故答案為:2;
(2)①沉錳過程中加入過量的碳酸氫銨,提供碳酸根將錳離子盡可能多的轉化為碳酸錳沉淀,提高Mn2+的沉淀率,其反應的離子反應方程式為Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,故答案為:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;提高Mn2+的沉淀率;
②銨鹽受熱易分解,當溫度過高時,碳酸氫銨容易分解,而溫度升高時,錳離子水解程度也會增大,所以沉錳反應的錳沉淀率隨溫度升高而下降,故答案為:溫度升高,NH4HCO3受熱分解(或Mn2+水解);
(3)沉錳后過濾得到MnCO3粗產品,用去離子水洗去表面的雜質離子,因為碳酸錳高溫時容易分解,所以干燥時用易揮發的乙醇低溫下除去水分,使碳酸錳快速干燥,得到純凈的碳酸錳,故答案為:有利于低溫條件下快速干燥。


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】(1)能判斷CO2(g)+H2(g)![]() CO(g)+H2O(g)達到化學平衡狀態的依據是____(填字母)。
CO(g)+H2O(g)達到化學平衡狀態的依據是____(填字母)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的濃度與時間的關系如圖所示。
FeO(s)+CO(g) ΔH>0,CO2的濃度與時間的關系如圖所示。

該條件下反應的平衡常數為_____;若鐵粉足量,CO2的起始濃度為2.0mol·L-1,則平衡時CO的濃度為____mol·L-1。
②下列措施中能使平衡時![]() 增大的是___(填字母)。
增大的是___(填字母)。
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下氨氣能與 CaCl2 固體結合生成 CaCl2·8NH3。下列說法不正確的是
A.CaCl2·6NH3(s)+ 2NH3(g) ![]() CaCl2·8NH3(s) ΔH < 0
CaCl2·8NH3(s) ΔH < 0
B.實驗室可用氯化銨固體和熟石灰共熱來制備氨氣,說明相對高溫不利于 CaCl2 與氨氣的化合
C.常溫下,在密閉容器中縮體加壓能增加體系中活化分子百分數,有利于氨氣的吸收
D.CaCl2·6NH3(s) CaCl2·c4NH3(s)+ 2NH3(g),He 氣流可促進反應進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用CO和H2合成CH3OH的化學方程式為CO(g)+2H2(g) ![]() CH3OH(g) AH<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示,下列說法正確的是( )
CH3OH(g) AH<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示,下列說法正確的是( )

A. 溫度:T1>T2>T3
B. 正反應速率:v(a)>v(c), v(b)>v(d)
C. 平衡常數:K(a)>K(c),K(b)=K(d)
D. 平均摩爾質量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KClO3和KHSO3能發生反應:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知該反應的速率隨c(H+)的增大而加快。下圖為用ClO3-在單位時間內物質的量濃度變化表示的該反應υ-t圖。下列說法正確的
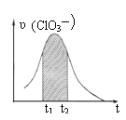
A. 反應開始時速率增大可能是c(H+)所致
B. 縱坐標為υ(Cl-)的υ-t曲線與圖中曲線不能完全重合
C. 后期速率υ下降的主要原因是反應向逆反應方向進行
D. 圖中陰影“面積”可以表示t1-t2時間內c(SO42-)增加量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作能達到實驗目的的是( )
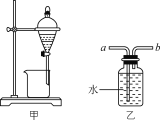
A.用裝置甲分液時,兩層液體應依次從下口放出
B.用裝置乙除去NO中混有的少量NO2時,應將混合氣體從a管通入
C.中和滴定時,錐形瓶應先用待測液潤洗2~3次
D.配制溶液時加水超過容量瓶的刻度線,應立即用膠頭滴管吸出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項中所示的物質間轉化均能實現的是( )
A.Al(s)![]() Al(OH)3(s)
Al(OH)3(s)![]() Al2O3(s)
Al2O3(s)
B.FeS2(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Cl2(g)![]() NaClO(aq)
NaClO(aq)![]() HClO(aq)
HClO(aq)
D.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非金屬單質A經如圖所示的過程轉化為含氧酸D,已知D為強酸,請回答下列問題。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常溫下為固體,B是能使品紅溶液褪色的有刺激性氣味的無色氣體:
①D的化學式是________;
②在工業生產中,B氣體的大量排放被雨水吸收后形成了________而污染了環境。
(2)若A在常溫下為氣體,C是紅棕色的氣體:
①A、C的化學式分別是:A________;C________。
②D的濃溶液在常溫下可與銅反應并生成C氣體,請寫出該反應的化學方程式_______________________________________________。該反應________(填“屬于”或“不屬于”)氧化還原反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(15分)含碳物質的價值型轉化,有利于“減碳”和可持續性發展,有著重要的研究價值。請回答下列問題:
(1)已知CO分子中化學鍵為C≡O。相關的化學鍵鍵能數據如下:
化學鍵 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡轉化率的措施有_______________(填標號)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡轉化率的措施有_______________(填標號)。
a.增大壓強 b.降低溫度
c.提高原料氣中H2O的比例 d.使用高效催化劑
(2)用惰性電極電解KHCO3溶液,可將空氣中的CO2轉化為甲酸根(HCOO),然后進一步可以制得重要有機化工原料甲酸。CO2發生反應的電極反應式為________________,若電解過程中轉移1 mol電子,陽極生成氣體的體積(標準狀況)為_________L。
(3)乙苯催化脫氫制取苯乙烯的反應為:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反應歷程如下:
(g)+CO(g)+H2O(g),其反應歷程如下:
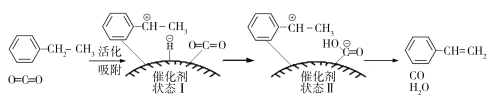
①由原料到狀態Ⅰ____________能量(填“放出”或“吸收”)。
②一定溫度下,向恒容密閉容器中充入2 mol乙苯和2 mol CO2,起始壓強為p0,平衡時容器內氣體總物質的量為5 mol,乙苯的轉化率為_______,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=_______。[氣體分壓(p分)=氣體總壓(p總)×氣體體積分數]
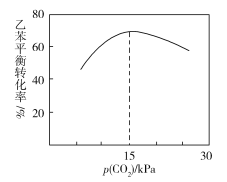
③乙苯平衡轉化率與p(CO2)的關系如下圖所示,請解釋乙苯平衡轉化率隨著p(CO2)變化而變化的原因________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com