
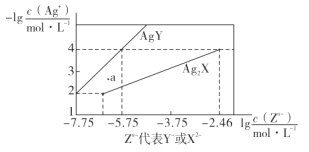
【題目】已知25° C時,二元酸H2X的電離平衡常數K1=5.0×10-2,K2=5.4×10-5。此溫度下用AgNO3溶液分別滴定濃度均為0.01mol·L-1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡圖像如圖所示。下列敘述正確的是
A.25°C時,KHX的溶液pH>7
B.反應Ag2X+2Y- 2AgY+ X2-的平衡常數為103.29
C.a點既可以表示AgY的不飽和溶液也可以表示Ag2X的過飽和溶液
D.向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液時,先生成AgY沉淀
【答案】D
【解析】
分析題中溶解平衡圖像可知,縱坐標為Ag+濃度的負對數,則縱坐標的值越大,Ag+的濃度越小,橫坐標為Y-或X2-的濃度的對數值,則橫坐標越大,Y-或X2-的濃度越大。由圖可知:當![]() 時,Ksp(AgY)=
時,Ksp(AgY)=![]() ,同理,可得Ksp(Ag2X)=
,同理,可得Ksp(Ag2X)=![]() 。據此進行分析。
。據此進行分析。
A、由HX-+H2O![]() H2X+OH-,可知,其水解常數Kh=
H2X+OH-,可知,其水解常數Kh=![]() <K2,說明KHX以電離為主,則25°C時,KHX的溶液pH<7,A項錯誤;
<K2,說明KHX以電離為主,則25°C時,KHX的溶液pH<7,A項錯誤;
B、由分析可知,反應Ag2X+2Y-![]() 2AgY+X2-的平衡常數為K=
2AgY+X2-的平衡常數為K=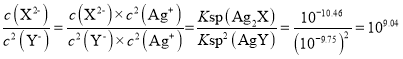 ,B項錯誤;
,B項錯誤;
C、由圖可知,a點時的Q(AgY)>Ksp(AgY),則a點表示AgY的過飽和溶液。同理,a點時的Q(Ag2X)<Ksp(Ag2X),則a點表示Ag2X的不飽和溶液。C項錯誤;
D、當c(Y-)=c(X2-)=0.01 mol·L-1時,若生成AgY沉淀,則c(Ag+)=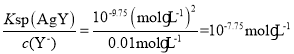 ;若生成Ag2X沉淀,則c(Ag+)=
;若生成Ag2X沉淀,則c(Ag+)=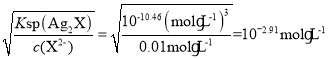 ,
,![]() 10-2.91mol·L-1>10-7.75mol·L-1。由此可知,向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液時,先生成AgY沉淀,D項正確;
10-2.91mol·L-1>10-7.75mol·L-1。由此可知,向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液時,先生成AgY沉淀,D項正確;
答案選D。


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
【題目】25 ℃時,部分物質的電離常數如下表所示:
化學式 | CH3COOH | H2C2O4 | H2S |
電離常數 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.0×10-7 Ka2=7.1×10-15 |
請回答下列問題:
(1)若把CH3COOH、H2C2O4、HC2O4-、H2S、HS- 都看作是酸,其中酸性最弱的是________。
(2)CH3COOH、H2C2O4、H2S的酸性由強到弱的順序為_____________________。
(3)NaHS溶液與NaHC2O4溶液反應的離子方程式為_______________。
(4)0.1 mol·L-1H2S溶液中c(H+)=________ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列三個化學反應的平衡常數(K1、K2、K3)與溫度的關系分別如下表所示:
化學反應 | 平衡常數 | 溫度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
則下列說法正確的是
A.△H1<0,△H2>0
B.反應①②③的反應熱滿足關系:△H2-△H1=△H3
C.反應①②③的平衡常數滿足關系:K1·K2=K3
D.要使反應③在一定條件下建立的平衡向正反應方向移動,可采取升溫措施
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關下圖所示實驗的預測現象不正確的是
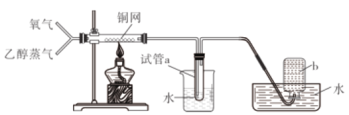
選項 | 操作 | 預測現象 |
A | 通入一段時間的氧氣后點燃酒精燈 | 銅網會逐漸變黑 |
B | 通入氧氣并加熱一段時間后通入乙醇蒸氣 | 銅網將逐漸變成紅色 |
C | 預先通入氧氣排凈裝置中的空氣后再進行實驗 | 集氣瓶b中不會收集到氣體 |
D | 觀察試管a中收集到的溶液 | 溶液無色有刺激性氣味 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)能判斷CO2(g)+H2(g)![]() CO(g)+H2O(g)達到化學平衡狀態的依據是____(填字母)。
CO(g)+H2O(g)達到化學平衡狀態的依據是____(填字母)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的濃度與時間的關系如圖所示。
FeO(s)+CO(g) ΔH>0,CO2的濃度與時間的關系如圖所示。

該條件下反應的平衡常數為_____;若鐵粉足量,CO2的起始濃度為2.0mol·L-1,則平衡時CO的濃度為____mol·L-1。
②下列措施中能使平衡時![]() 增大的是___(填字母)。
增大的是___(填字母)。
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有某鐵碳合金,某化學興趣小組為了測定鐵碳合金中鐵的質量分數,并探究濃硫酸的還原產物,設計了如圖所示的實驗裝置和實驗方案(夾持儀器已省略),請你參與此項活動并回答相應問題:
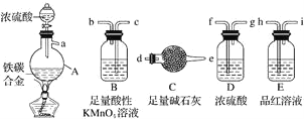
(1)該裝置的連接順序a___(填接口字母),連接好裝置后,首先應進行的操作是____。
(2)mg鐵碳合金中加入濃H2SO4,點燃酒精燈一段時間后,用滴管吸取A中的溶液滴入到適量水中作為試樣,試樣中所含金屬離子的成分有以下三種可能:A:只含有Fe3+;B:只含有Fe2+;C:____,若為A,則A中反應的化學方程式為___,驗證C種可能的實驗方法___。
(3)待A中不再逸出氣體時,停止加熱,拆下C并稱重,C增重bg。鐵碳合金中鐵的質量分數____(寫表達式)。
(4)某同學認為利用此裝置測得鐵的質量分數偏大,請你寫出可能的原因:_____。
(5)隨著反應的進行,A中還可能發生某些離子反應。寫出相應的離子方程式____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一張已除去表面氧化膜的鋁箔緊緊包裹在試管外壁(如右圖),將試管浸入硝酸汞溶液中,片刻取出,然后置于空氣中,不久鋁箔表面生出“白毛”,紅墨水柱右端上升。根據實驗現象判斷下列說法錯誤的是( )

A.實驗中發生的反應都是氧化還原反應
B.鋁是一種較活潑的金屬
C.鋁與氧氣反應放出大量的熱量
D.鋁片上生成的白毛是氧化鋁和氧化汞的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KClO3和KHSO3能發生反應:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知該反應的速率隨c(H+)的增大而加快。下圖為用ClO3-在單位時間內物質的量濃度變化表示的該反應υ-t圖。下列說法正確的
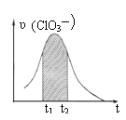
A. 反應開始時速率增大可能是c(H+)所致
B. 縱坐標為υ(Cl-)的υ-t曲線與圖中曲線不能完全重合
C. 后期速率υ下降的主要原因是反應向逆反應方向進行
D. 圖中陰影“面積”可以表示t1-t2時間內c(SO42-)增加量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com