
某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗。
實驗一:配制并標定醋酸溶液的濃度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀釋成所需濃度的溶液,再用NaOH標準溶液對所配醋酸溶液的濃度進行標定。回答下列問題:
(1)配制250 mL 0.2 mol·L-1醋酸溶液時需要用到的玻璃儀器有量筒、燒杯、玻璃棒、 和 。
(2)為標定某醋酸溶液的準確濃度,用0.200 0 mol·L-1的NaOH溶液對20.00 mL醋酸溶液進行滴定,幾次滴定消耗NaOH溶液的體積如下:
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸濃度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
科目:高中化學 來源: 題型:填空題
二氧化鈦廣泛應用于各類結構表面涂料、紙張涂層等,二氧化鈦還可作為制備鈦單質的原料。
Ⅰ.二氧化鈦可由以下兩種方法制備:
方法1:可用含有Fe2O3的鈦鐵礦(主要成分為FeTiO3,其中Ti元素化合價為+4價)制取,其主要流程如下:
(1)Fe2O3與H2SO4反應的離子方程式是_________________________________。
(2)甲溶液中除含TiO2+之外還含有的金屬陽離子有__________________。
(3)加Fe的作用是_________________________________。
方法2:TiCl4水解生成TiO2·x H2O,過濾、水洗除去其中的Cl-,再烘干、焙燒除去水分得到粉體TiO2,此方法制備得到的是納米二氧化鈦。
(4)① TiCl4水解生成TiO2·x H2O的化學方程式為_______________________________;
② 檢驗TiO2·x H2O中Cl-是否被除凈的方法是______________________________。
Ⅱ.二氧化鈦可用于制取鈦單質
(5)TiO2制取單質Ti,涉及到的步驟如下:
反應②的方程式是 ,該反應需要在Ar氣氛中進行,請解釋原因:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業碳酸鈉(純度約為98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等雜質,提純工藝線路如圖所示: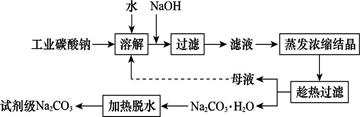
Ⅰ.碳酸鈉的飽和溶液在不同溫度下析出的溶質如圖所示:
Ⅱ.有關物質的溶度積如下
| 物質 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(7分)用中和滴定法測定燒堿的純度,若燒堿中含有與酸不反應的雜質,試根據實驗回答:
(1)將準確稱取的4.3 g燒堿樣品配制成250 mL待測液,需要的主要儀器除量筒、燒杯、玻璃棒、膠頭滴管外,還必須用到的儀器有 。
(2)取待測液10.00 mL,用 滴定管量取,并置于錐形瓶中。
(3)向錐形瓶中滴加幾滴指示劑,用0.200 mol·L-1標準鹽酸滴定待測燒堿溶液。不適宜選用的指示劑為(選填序號):________。①石蕊試液 ②無色酚酞 ③甲基橙試液
(4)根據兩次滴定獲得的實驗數據如下表,得出燒堿的純度為 。
| 滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某學生用0.200 0 mol·L-1的標準NaOH溶液滴定未知濃度的鹽酸,其操作為如下幾步:
①用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度線以上
②固定好滴定管并使滴定管尖嘴充滿液體
③調節液面至“0”或“0”刻度線以下某一刻度,并記下讀數
④移取20.00 mL待測液注入潔凈的錐形瓶中,并加入3滴酚酞溶液
⑤用標準液滴定至終點,記下滴定管液面讀數
請回答:
(1)以上步驟有錯誤的是 (填編號),該錯誤操作會導致測定結果(填“偏大”、“偏小”或“無影響”) 。
(2)判斷滴定終點的現象是:錐形瓶中溶液從 色變為________色, 且半分鐘內不變色。
(3)如圖是某次滴定時的滴定管中的液面,其讀數為 mL。
(4)根據下列數據:請計算待測鹽酸溶液的濃度為 mol/L。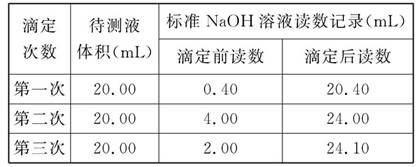
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某燒堿樣品中含有少量不與酸作用的可溶性雜質,為了測定其純度,進行以下滴定操作:
| A.在250mL容量瓶中定容成250mL燒堿溶液; |
| B.用堿式滴定管移取25mL燒堿溶液于錐形瓶中并滴加幾滴甲基橙作指示劑; |
| C.在天平上準確稱取燒堿樣品mg,在燒杯中加蒸餾水溶解; |
| D.將物質的量濃度為C mol·L-1的標準H2SO4溶液裝入酸式滴定管,調整液面,記下開始刻度為V1mL; |


 D
D  。
。查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
為測定某品牌洗廁精的酸(鹽酸)含量,某學生欲用已知物質的量濃度的NaOH溶液來測定該洗廁精(鹽酸)的物質的量濃度時,選擇酚酞作指示劑。請填寫下列空白:
(1)堿式滴定管的使用方法,正確步驟的先后順序為(填選項符號):
A.用氫氧化鈉溶液潤洗儀器并加入氫氧化鈉溶液
B.放出氫氧化鈉溶液進行滴定
C.調節起始讀數
D.查漏,再水洗2-3遍
(2)用標準的NaOH溶液滴定待測的鹽酸時,左手控制堿式滴定管的玻璃球,右手搖動錐形瓶,眼睛應注視 ;
(3)若滴定開始和結束時,堿式滴定管中的液面如上圖所示:則所用NaOH溶液的體積為 mL。
(4)某學生根據三次實驗分別記錄有關數據如下表:
| 滴定次數 | 待測鹽酸的體積/mL | 0.1000 mol/LNaOH溶液的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
草酸合鐵(Ⅲ)酸鉀晶體Kx[Fey(C2O4)z]·nH2O可用于攝影和藍色印刷。為確定其組成,某化學興趣小組在沒有氧氣干擾下進行如下實驗:
實驗Ⅰ.草酸根含量的測定
稱取0.9820 g樣品放入錐形瓶中,加入適量稀硫酸和一定量水,加熱至343~358 K,用0.2000
mol/LKMnO4溶液滴定,滴定過程中草酸根離子轉變成CO2逸出反應容器,KMnO4轉變成Mn2+。達到滴定終點時,共消耗KMnO4溶液12.00 ml。
實驗Ⅱ.鐵含量的測定
將上述滴定過草酸根的保留液充分加熱,使淡紫紅色消失。冷卻后,調節溶液pH并加入過量的KI固體,充分反應后調節pH至7左右,滴入幾滴淀粉溶液做指示劑,用0.2500mol·L-1 Na2S2O3標準溶液滴定至終點,共消耗Na2S2O3溶液8.00 ml。(已知:實驗Ⅱ中涉及的部分離子方程式為:I2+2S2O32-=2I-+S4O62-)
請根據上述實驗回答下列問題
(1)實驗Ⅰ在滴定過程中反應的離子方程式為 。
(2)MnO4-在酸性條件下,加熱能分解為O2,同時生成Mn2+。若實驗Ⅱ中沒有對實驗Ⅰ的保留液進
行充分加熱,則測定的Fe3+的含量將會 (填“偏高”、“偏低” 或“不變”)。
(3)實驗Ⅱ用淀粉溶液做指示劑,則滴定終點觀察到的現象為 。
(4)通過計算確定樣品晶體的組成(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關原電池的說法中,正確的是( )
A.鋁片和鎂片用導線連接后插入NaOH溶液中,鎂片較活潑,作負極
B鋁片和銅片用導線連接后插入濃硝酸中,銅作負極
C.鍍鋅鐵和鍍錫鐵的鍍層破損后,前者較易被腐蝕
D.將反應2Fe3++Fe===3Fe2+設計為原電池,則可用鋅片作負極,鐵片作正極,FeCl3溶液作電解質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com