
【題目】苯乙烯是重要的化工原料。下列有關苯乙烯的說法錯誤的是
A. 與液溴混合后加入鐵粉可發生取代反應
B. 與氯化氫反應可以生成氯代苯乙烯
C. 能使酸性高錳酸鉀溶液褪色
D. 在催化劑存在下可以制得聚苯乙烯
【答案】B
【解析】
苯乙烯結構簡式為![]() ,
,
A.苯環能和液溴在溴化鐵作催化劑條件下發生取代反應;
B.該物質在一定條件下能與HCl發生加成反應而不是取代反應;
C.碳碳雙鍵能被酸性高錳酸鉀溶液氧化而使酸性高錳酸鉀溶液褪色;
D.碳碳雙鍵在一定條件下能發生加聚反應。
苯乙烯結構簡式為![]() ,
,
A.根據結構可知:苯乙烯中含有苯環,苯環能和液溴在溴化鐵作催化劑條件下發生苯環上取代反應,選項A正確;
B.該物質分子中含碳碳雙鍵,在一定條件下能與HCl發生加成反應,生成1-氯苯乙烷、2-氯苯乙烷,而不是發生取代反應,選項B錯誤;
C.物質分子結構中含有碳碳雙鍵,碳碳雙鍵能被酸性高錳酸鉀溶液氧化而使酸性高錳酸鉀溶液褪色,選項C正確;
D.碳碳雙鍵在一定條件下能發生加聚反應,生成聚苯乙烯,選項D正確;
故合理選項是B。


科目:高中化學 來源: 題型:
【題目】工業氧化鈹可生產金屬鈹、制作鈹合金及特殊陶瓷。由綠柱石(含3BeO·Al2O3·6SiO2及鐵等微量元素)和方解石(主要成分是CaCO3)為原料生產氧化鈹的工藝流程如下:

已知:Be與Al性質相似。下列敘述錯誤的是
A. “浸渣”受熱后的主要成分是SiO2和CaSO4
B. 利用“堿溶渣”可回收金屬鐵
C. “水解,調節pH”反應的主要離子是BeO22-
D. 上述流程中“堿、水”宜使用廉價的氨水,降低生產成本
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用碳酸鈉晶體(Na2CO310H2O)配制 0.1mol/L 的碳酸鈉溶液,正確的方法是
A. 稱量 10.6g 碳酸鈉晶體,溶解在 1L 水中
B. 稱量 28.6g 碳酸鈉晶體,溶解在 1L 水中
C. 稱量 14.3g 碳酸鈉晶體,溶解在適量水中,然后在容量瓶中加水到 1L
D. 稱量 14.3g 碳酸鈉晶體,溶解在適量水中,然后在容量瓶中加水到 500mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄糖酸亞鐵((C6H11O7)2Fe)是常用的補鐵劑,易溶于水,幾乎不溶于乙醇。用下圖裝置制備FeCO3,并利用FeCO3與葡萄糖酸反應可得葡萄糖酸亞鐵。回答下列問題:
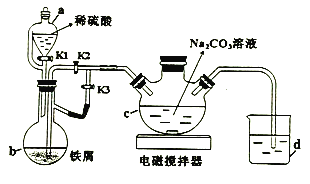
(1)a的名稱為_________。
(2)打開a中K1、K3,關閉K2,一段時間后,關閉K3,打開K2。在_________(填儀器標號)中制得碳酸亞鐵。實驗過程中產生的H2作用有_________、____________。(寫2條)
(3)將制得的碳酸亞鐵濁液過濾、洗滌。如過濾時間過長會發現產品部分變為紅褐色。用化學方程式說明原因____________。
(4)將葡萄糖酸與碳酸亞鐵混合,加入乙醇、過濾、洗滌、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制備碳酸亞鐵,同時有氣體產生,離子方程式為______________,此法產品純度更高,原因是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研小組公司開發了Li-SO2Cl2軍用電池,其示意圖如圖所示,已知電池反應為:2Li+SO2Cl2=2LiCl+SO2↑。下列敘述中錯誤的是

A. 電池工作時負極材料是Li,發生氧化反應
B. 將電解質溶液改為LiCl的水溶液,電池性能會更好
C. 電池工作時電子流向:鋰電極→導線→負載→碳棒
D. 電池工作過程中,石墨電極反應式為SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨硼烷(NH3·BH3)作為一種非常有前景的儲氫材料,近年來日益受到人們的重視。氨硼烷(NH3·BH3)電池可在常溫下工作,裝置如下圖所示。該電池的總反應為:NH3·BH3+3H2O2=NH4BO2+4H2O。下列說法正確的是( )

A. 右側電極發生氧化反應 B. 電池工作時,H+通過質子交換膜向左側移動
C. 負極的電極反應式為H2O2+2H++2e-=2H2O D. 每消耗31g氨硼烷,理論上應轉移6mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2、CO、CO2、NOx是對環境影響較大的幾種氣體,對它們的合理控制和治理是優化我們生存環境的有效途徑.

(1)利用電化學原理將CO、SO2轉化為重要化工原料,裝置如圖1所示:
①若A為CO,B為H2,C為CH3OH,則通入CO的為_________極(填“正”或“負”)。
②若A為SO2,B為O2,C為H2SO4,則負極的電極反應式為:___________________________。
(2)碳酸鹽燃料電池,以一定比例Li2CO3和Na2CO3低熔混合物為電解質,操作溫度為650℃,在此溫度下以鎳為催化劑,以煤氣(CO、H2的體積比為1∶1)直接做燃料,其工作原理如圖2所示。
①電池總反應為____________________________________________。
②以此電源電解足量的硝酸銀溶液,若陰極產物的質量為21.6g,電解后溶液體積為2L,溶液的pH約為___________。
(3)某研究小組利用下列裝置用N2O4生產新型硝化劑N2O5。

①現以H2、O2、熔融鹽Na2CO3組成燃料電池,采用電解法制備N2O5,裝置如圖所示,其中Y為CO2。在該電極上同時還引入CO2的目的是__________________________。
②電解過程中,生成N2O5的電極反應方程式為_________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com