
【題目】某校化學小組的同學開展了一系列的化學實驗活動。

請你參與實驗并完成下列問題:
(1)甲同學用圖1所示裝置,測量鋅與硫酸反應速率:把2 g鋅粒放入錐形瓶內,通過分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL氣體,通過記錄 得到反應速率為x mol·(L·min)-1。實驗開始時檢查該裝置氣密性的方法是 。
(2)乙同學用圖2裝置測定Na2CO3和NaCl的固體混合物中Na2CO3的質量分數:
①甲、乙兩試管各有兩根導管,用橡膠管連接對應接口后,倒置盛稀硫酸的試管,發生反應,放出氣體,則固體混合物和稀硫酸應分別置于 、 儀器中(填儀器編號);
②G管可以用化學實驗室里的一種常用儀器來替代,這種儀器是 ;
③儀器甲、乙接口的連接方式如下:A連接 ,B連接 ,C連接 (填寫各接口的編號);
④為提高測量的準確性,收集完氣體后,丙裝置讀數前應進行的操作是 。
(3)丙同學與甲同學實驗目的相同:用圖3裝置測定生成的CO2的質量,但該裝置存在明顯缺陷,從而導致實驗誤差,請你分析其中使測定結果可能偏大的主要原因 。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列實驗的反應原理用離子方程式表示正確的是( )
A. 室溫下,測得氯化銨溶液pH<7,證明一水合氨是弱堿:NH4++2H2O===NH3·H2O+H3O+
B. 用氫氧化鈉溶液除去鎂粉中的雜質鋁:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 用碳酸氫鈉溶液檢驗水楊酸中的羧基: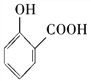 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高錳酸鉀標準溶液滴定草酸:2MnO4-+16H++5C2O4-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O5是一種新型硝化劑,其性質和制備受到人們的關注。一定溫度下,在2 L固定容積的密閉容器中發生反應:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反應物和部分生成物的物質的量隨反應時間變化的曲線如圖所示。下列正確的是:
4NO2(g)+O2(g) ΔH>0。反應物和部分生成物的物質的量隨反應時間變化的曲線如圖所示。下列正確的是:

A. 0-20 s內平均反應速率v(N2O5)=0.1 mol·L-1·s-1
B. 10 s時,正、逆反應速率相等,達到平衡
C. 20 s時,正反應速率大于逆反應速率
D. 曲線a表示NO2的物質的量隨反應時間的變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分被氧化的Fe-Cu合金樣品(氧化產物為Fe2O3、CuO)共8.0 g,經如下處理:

下列說法正確的是
A.濾液A中的陽離子為Fe2+、Fe3+、H+
B.該樣品中Cu、O元素的質量比為10:l
C.V=448
D.溶解樣品時消耗H2SO4的物質的量為0.04 mo1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 的
的![]() 溶液中
溶液中![]() 的濃度為
的濃度為![]() ,請回答下列問題:
,請回答下列問題:
(1)下列物質能導電的是__________,屬于電解質的是__________,屬于非電解質的是__________,(填序號)
①氯化鈉晶體 ②氨氣 ③水銀 ④蔗糖 ⑤石墨 ⑥熔融![]() ⑦空氣 ⑧BaSO4 ⑨稀鹽酸
⑦空氣 ⑧BaSO4 ⑨稀鹽酸
(2)寫出![]() 在水溶解中的電離方程式:_________________;寫出NaHSO4在熔融狀態下的電離方程式:_______________________________。
在水溶解中的電離方程式:_________________;寫出NaHSO4在熔融狀態下的電離方程式:_______________________________。
(3)![]() 溶液與NaHCO3溶液混合有氣泡生成,反應的離子方程式_______________
溶液與NaHCO3溶液混合有氣泡生成,反應的離子方程式_______________
(4)①若![]() 與
與![]() 溶液混合后溶液顯中性,請寫出反應的離子方程式_________________________________________________________________。
溶液混合后溶液顯中性,請寫出反應的離子方程式_________________________________________________________________。
②若![]() 與
與![]() 溶液中混合溶液呈堿性,請寫出反應的離子方程式___________________________________________________。
溶液中混合溶液呈堿性,請寫出反應的離子方程式___________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)+6價鉻的化合物毒性較大,常用NaHSO3將廢液中的Cr2O![]() 還原成Cr3+,該反應的離子方程式為__________________________________________________________。
還原成Cr3+,該反應的離子方程式為__________________________________________________________。
(2)向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,發生反應的離子方程式為____________________________________。
(3) “酸浸”時V2O5轉化為VO![]() ,反應的離子方程式為________________________________________。
,反應的離子方程式為________________________________________。
(4)在H2SO4的酸性環境中ClO2與碘化鉀反應的離子方程式___________________________。
(5)已知在酸性條件下NaClO2可發生反應生成NaCl并釋放出ClO2,該反應的離子方程式為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門以實驗為基礎的自然科學,化學實驗在化學學習中具有極其重要的作用.
(1)下列有關實驗的敘述,正確的是_______.
(A)配制500mL某物質的量濃度的溶液,可用兩只250mL的容量瓶
(B)用滲析法分離淀粉中混有的NaCl雜質
(C)無法用分液漏斗將甘油和水的混合液體分離
(D)用酸式滴定管量取20. 00mL高錳酸鉀溶液
(E)為了測定某溶液的pH,將經水潤濕的pH試紙浸入到待測溶液,過一會取出,與標準比色卡進行對比
(F)用濃氨水洗滌做過銀鏡反應的試管
(G)配制銀氨溶液時,將稀氨水慢慢滴加到硝酸銀溶液中,產生沉淀后繼續滴加到沉淀剛好溶解為止
(H)配制一定濃度的溶液時,若定容時不小心加水超過容量瓶的刻度線,應立即用滴管吸去多余的部分。
(J)在氫氧化鐵膠體中加少量硫酸會產生沉淀
(K)用結晶法可以除去硝酸鉀中混有的少量氯化鈉
(2)如圖為常見儀器的部分結構(有的儀器被放大):
A圖中液面所示溶液的體積為__________mL,用上述四種儀器中的某種測量一液體的體積,平視時讀數為NmL,仰視時讀數為MmL,若M>N,則所使用的儀器是___________(填字母標號)。
(3)下圖為實驗室某濃鹽酸試劑瓶上的標簽,試根據有關數據回答下列問題:
鹽酸
分子式:HCl
相對分子量: 36.5
密度:1.2g/ml
HCl質量分數:36.5%
①該濃鹽酸中HCl的物質的量濃度為_________mol/L。
②某學生欲用上述濃鹽酸和蒸餾水配制500 mL物質的量濃度為0.3 mol/L稀鹽酸。
Ⅰ.該學生需要量取________mL上述濃鹽酸進行配制。
II.在配制過程中,下列實驗操作會使所配制的稀鹽酸的物質的量濃度偏高的是______。
A.用量筒量取濃鹽酸時俯視觀察凹液面
B.溶液注入容量瓶前沒有恢復到室溫就進行定容
C.定容時仰視刻度線
D.在配罝前用已知濃度的稀鹽酸潤洗容量瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C俗稱苦杏仁酸,是一種重要的化工原料,F是抗抑郁藥物米氮平的一種重要的中間體,它們可由下列路線合成:

已知:![]() (R,R,代表氫原子或氰基)
(R,R,代表氫原子或氰基)
(1)A的名稱是_________;C→D的反應類型是________________。
(2)C中的含氧官能團名稱是_______________。
(3)下列關于C、E的說法正確的是__________。
a.都屬于芳香族化合物 b.都能發生取代反應
c.所含含氧官能團完全相同 d.在氫氧化鈉溶液中都能發生水解反應
(4)寫出E在氫氧化鈉溶液中加熱水解的化學方程式_____________________________。
(5)寫出由C生成高聚物P的化學方程式_____________________。
(6)同時滿足下列條件的C的同分異構體共有_______種。
①與濃溴水作用有白色沉淀生成;
②既能發生水解反應也能發生銀鏡反應,
這些同分異構體中,屬于二取代苯且核磁共振氫譜顯示5個吸收峰的同分異構體的結構簡式是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅(CuCl)是白色粉末,微溶于水,能與稀硫酸反應,廣泛應用于化工和印染等行業。某研究性學習小組擬熱分解CuC122H2O制備CuCl,并進行相關探究(已知酸性條件下Cu+不穩定)。

下列說法正確的是
A. X氣體可以是N2,目的是做保護氣,抑制CuCl22H2O加熱過程可能的水解
B. CuCl與稀硫酸反應的離子方程式為:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
C. 途徑1中產生的Cl2可以回收循環利用,也可以通入飽和CaCl2溶液中除去
D. 途徑2中200℃下反應的化學方程式為:Cu2(OH)2Cl2![]() 2CuO + 2HCl
2CuO + 2HCl
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com