
【題目】2016年8月國際期刊eLife上發表了浙江醫科大學第二醫院和浙江大學腫瘤研究的晁明和胡汛等人的一片論文,引發轟動。媒體以廉價的小蘇打協助餓死了癌細胞予以報道。在實驗室中模擬工業制取NaHCO3的實驗步驟如下:
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓某一裝置發生反應,直到產生的氣體不能再在C中溶解,再通入另一裝 置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:分離C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的某固體粉末,有NH4Cl晶體析出。
(1)下圖所示裝置的連接順序是:a接______;_____接________;b接________(填接口編號)
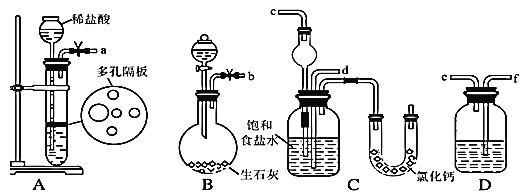
(2)檢查A裝置氣密性的具體操作是___________。
(3)A中常選用的固體反應物為_________;D中應選用的液體為______。
(4)裝有無水CaCl2的U形管的作用是 _______。
(5)第四步所得的晶體中常含有少量的NaCl和NaHCO3(約占5%~8%),請設計一個簡單實驗,不使用其他任何試劑,證明所得晶體大部分是NH4C1。簡要寫出操作和現象________。
【答案】f e d c 關閉彈簧夾,通過長頸漏斗往試管中加水,使長頸漏斗中的水面高于試管中的水面,靜置片刻,漏斗內水面不下降,說明A裝置氣密性良好。 石灰石(或大理石或塊狀CaCO3) 飽和NaHCO3溶液(或飽和碳酸氫鈉溶液) 吸收多余的NH3 取少量固體放入試管中,加熱,固體大部分消失,在試管口內壁又有較多的固體凝結。
【解析】
制備NaHCO3發生反應式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,A裝置實驗室制取二氧化碳,先用飽和碳酸氫鈉溶液除去HCl氣體,B裝置實驗室制取氨氣,最后通入到C裝置中進行反應生成碳酸氫鈉和氯化銨。
⑴制備NaHCO3發生反應式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,裝置A制備CO2,制出CO2混有HCl必須除去,因為HCl會與NH3,增加副產物,因此a接f,裝置B制備NH3,NH3易溶于水,要防止倒吸,因此e接d,b接c;
故答案為:f;e;d;c
⑵檢查裝置氣密性,先封閉體系,再操作,再說結論,因此檢查裝置A氣密性操作為關閉彈簧夾,通過長頸漏斗往試管中加水,使長頸漏斗中的水面高于試管中的水面,靜置片刻,漏斗內水面不下降,說明A裝置氣密性良好。
故答案為:關閉彈簧夾,通過長頸漏斗往試管中加水,使長頸漏斗中的水面高于試管中的水面,靜置片刻,漏斗內水面不下降,說明A裝置氣密性良好;
⑶裝置A制備CO2,此裝置是啟普發生器的簡易裝置,因此用的反應物是石灰石或大理石或塊狀CaCO3,裝置D的作用是除去CO2中混有HCl,因此裝置D中盛放是飽和碳酸氫鈉溶液;
故答案為:石灰石(或大理石或塊狀CaCO3);飽和NaHCO3溶液(或飽和碳酸氫鈉溶液);
⑷干燥管的作用是防止倒吸,NH3有毒,防止NH3污染空氣,因此無水氯化鈣的作用是吸收多余的NH3,防止污染空氣;
故答案為:吸收多余的NH3;
⑸由于NH4Cl受熱易分解,可以通過固體減少的量判斷產物的含量,因此操作是:取少量固體放入試管中,加熱,固體大部分消失,在試管口內壁又有較多的固體凝結。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】關于物質的量的計算:
(1)等質量的二氧化硫和三氧化硫,它們的物質的量之比為____,所含分子數之比為____,同溫同壓下的體積之比為_____。
(2)0.2mol HCl氣體溶于水配成200mL的鹽酸,此鹽酸的物質的量濃度為____,中和此稀鹽酸,需NaOH固體的質量為____。
(3)某氣態氧化物的化學式為RO2,標準狀況下0.88g該氧化物的體積為448mL,則該氧化物的摩爾質量為_____,R的相對原子質量為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1) 與氫氣反應的化學方程式是__________;
與氫氣反應的化學方程式是__________;
(2)寫出正戊烷CH3(CH2)3CH3的兩種同分異構體的結構簡式和名稱(系統命名法):
①結構簡式:_____________、名稱:_____________
②結構簡式:_____________、名稱:_____________。
(3)某一氯代烷烴分子中有2個“-CH3”、2個“-CH2-”、1個“ ”和1個“-Cl”,符合上述條件的有機物共四種,寫出它們的結構簡式:
”和1個“-Cl”,符合上述條件的有機物共四種,寫出它們的結構簡式:![]() 、
、 、_________、_________。
、_________、_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】類推思維是化學解題中常用的一種思維方法,下列有關反應方程式的類推正確的是
已知 | 類推 | |
A | 將Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 將Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸與Ba(OH)2溶液反應至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液與Ba(OH)2溶液反應至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 鐵和氯氣反應2Fe+3Cl2 | 鐵和碘單質反應2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用廢鐵屑(主要成分為Fe,還含有C,S,P等)制取高效凈水劑K2FeO4流程如圖:

下列說法不正確的是
A. 廢鐵屑在酸溶前可用熱的純堿溶液去油污
B. 步驟②是將Fe2+轉化為Fe(OH)3
C. 步驟③中發生的反應的離子方程式為2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. 步驟④中反應能發生的原因是在相同條件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式表示正確的是 ( )
A. 往FeI2溶液中通入過量氯氣:Cl2+2I —=2Cl-+2I2
B. 銅與稀硝酸反應:3Cu+4H++2NO3—=3Cu2++2NO↑+2H2O
C. 大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
D. 將FeCl3溶于水生成膠體:Fe3++3H2O![]() Fe(OH)3(膠體)+3H+
Fe(OH)3(膠體)+3H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度恒定的條件下,在2 L容積不變的密閉容器中,發生反應:2SO2(g)+O2(g) ![]() 2SO3(g)。開始充入4 mol的SO2和2 mol的O2,10 s后達到平衡狀態,此時c(SO3)=0.5 mol·L-1,下列說法不正確的是 ( )
2SO3(g)。開始充入4 mol的SO2和2 mol的O2,10 s后達到平衡狀態,此時c(SO3)=0.5 mol·L-1,下列說法不正確的是 ( )
A.v(SO2)∶v(O2)=2∶1B.10 s內,v(SO3)=0.05 mol·L-1·s-1
C.SO2的平衡轉化率為25%D.平衡時容器內的壓強是反應前的5/6倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A可由葡萄糖發酵得到,也可從酸牛奶中提取。純凈的A為無色粘稠液體,易溶于水。為研究A的組成與結構,進行了如下實驗:
(1)稱取A9.0g,升溫使其汽化,測其密度是相同條件下H2的45倍。則A的相對分子質量為:______。
(2)將此9.0gA在足量純O2充分燃燒,并使其產物依次緩緩通過濃硫酸、堿石灰,發現兩者分別增重5.4g和13.2g。則A的分子式為:________。
(3)另取A9.0g,跟足量的NaHCO3粉末反應,生成2.24LCO2(標準狀況),若與足量金屬鈉反應則生成2.24LH2(標準狀況)。用結構簡式表示A中含有的官能團:______________________。
(4)A的核磁共振氫譜如下圖:則A中含有__________種氫原子。
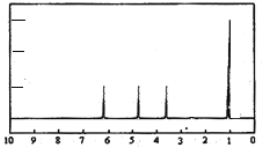
(5)綜上所述,A的結構簡式_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2 L的密閉容器中發生反應xA(g)+yB(g)![]() zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )
zC(g)。圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )
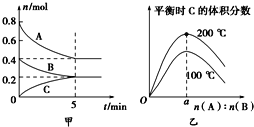
A. 200℃時,反應從開始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃時,該反應的平衡常數為25
C. 當外界條件由200℃降溫到100℃,原平衡一定被破壞,且正逆反應速率均增大
D. 由圖乙可知,反應xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com