
【題目】一定溫度下,在三個恒容休積均為2.0L的容器中發生反應:PCl5(g) ![]() PCl3(g)+Cl2(g),下列說法正確的是
PCl3(g)+Cl2(g),下列說法正確的是
編號 | 溫度(℃) | 起始/(mol) | 平衡/(mol) | 達到平衡所需時間(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列說法正確的是
A. 平衡常數K:容器Ⅱ>容器Ⅲ
B. 反應到達平衡時,PCl5的轉化率:容器Ⅱ>容器Ⅰ
C. 反應到達平衡時,容器I中的平均速率為v(PCl5)=0.1/t1mol/(Ls)
D. 起始時向容器Ⅲ中充入PCl50.30mol、PCl30.45mol和Cl20.10mol,則反應將向逆反應方向進行
【答案】D
【解析】試題解析: A、平衡常數只與溫度有關,溫度不變,平衡常數不變,I中K=[0.1/2×0.1/2]/(0.4-0.1)/2=0.03; 容器III中K=[0.15/2×0.15/2]/(0.4-0.15)/2=0.045; 即平衡常數K:容器Ⅱ<容器Ⅲ,故A錯誤;B、PCl5(g)=PCl3(g)+Cl2(g),此反應正反應方向為壓強增大的反應,增大壓強,平衡左移,即PCl5的轉化率:容器Ⅱ<容器Ⅰ,B錯誤;C。 v(Cl2)=0.1/2/ t1==v(PCl5)="0.05" molL-1s-1C錯誤;D、由Ⅲ得出此時K=[0.15/2×0.15/2]/(0.4-0.15)/2==0.09,起始時向容器Ⅲ中充入PCl50.30 mol、PCl30.45 mol和Cl20.10 mol,則此時Qc=[0.1/2×0.45/2]/0.3/2=0.075;由于Qc<0.09,故平衡左移,故D正確;
考點: 化學平衡的影響因素;


科目:高中化學 來源: 題型:
【題目】化學與社會、生產、生活緊切相關。下列說法正確的是
A. 石英只能用于生產光導纖維
B. 從海水提取物質都必須通過化學反應才能實現
C. 為了增加食物的營養成分,可以大量使用食品添加劑
D. 減少使用一次性筷子、紙杯、塑料袋等有利于環境保護
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與環境、材料、能源等關系密切。下列說法正確的是
A. 焚燒廢舊塑料以防止“白色污染”
B. 大量CO2排放可導致酸雨的形成
C. 積極開發風力、太陽能發電,改善能源結構
D. 瑪瑙、水晶、鉆石、紅寶石等裝飾品的主要成分都是硅酸鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關,則下列說法不正確的是
A. Fe2O3常用作紅色油漆和涂料
B. 植物油與礦物油的化學成分完全相同
C. 聚丙烯酸鈉可作“尿不濕”原料
D. 液氯或者濃硫酸均可以用鋼瓶儲存
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積恒定的密閉容器中,一定量的SO2與1.1 mol O2發生反應:2SO2(g) + O2(g)![]() 2SO3(g) △H<0。當氣體的物質的量減少0.315 mol時,反應達到平衡,SO2的平衡轉化率是90%。下列說法正確的是
2SO3(g) △H<0。當氣體的物質的量減少0.315 mol時,反應達到平衡,SO2的平衡轉化率是90%。下列說法正確的是
A.相同條件下,平衡時若充入稀有氣體,SO2的轉化率增大
B.反應開始時,向容器中通入的SO2的物質的量是0.7 mol
C.保持其他條件不變,僅降低溫度,正反應速率減小程度比逆反應速率減小程度大
D.保持其他條件不變,僅縮小容器體積,反應達到平衡時容器中有1.485 mol氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2H2(g)+O2(g)=2H2O(g)ΔH1;2H2(g)+O2(g)=2H2O(l)ΔH2。則下列關于ΔH1與ΔH2大小比較中正確的是( )
A.無法確定 B.ΔH1 <ΔH2 C.ΔH1 =ΔH2 D.ΔH1>ΔH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機化合物與人類生活密不可分,生活中的一些問題常涉及化學知識。
(1)有下列幾種食品:

①花生油中所含人體所需的主要營養物質為___________(填“糖類”、“油脂”或“蛋白質”)。
②吃飯時,咀嚼米飯一會兒后感覺有甜味,是因為淀粉發生了_____________(填字母)反應。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法錯誤的是________。
A.用燃燒法鑒別毛織品和棉織品
B.用純堿洗滌鍋蓋上的油漬
C.用聞氣味的方法鑒別白酒和米醋
D.用淀粉溶液鑒別加碘食鹽和不含碘的食鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探索工業含鋁、鐵、銅合金廢料的再利用,甲同學設計的實驗方案如下:
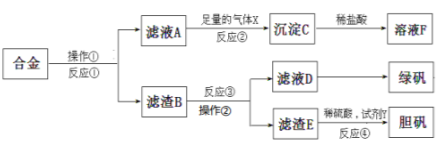
請回答:
(1)反應①、反應③所加試劑分別是___________、____________。從濾液D中得到綠礬晶體的實驗操作是________________。
(2)寫出反應①的化學方程式____________,反應②生成沉淀的離子反應方程式__________________。
(3)用NaOH檢測濾液D中含有的金屬離子,實驗現象是:____________,其中涉及的氧化還原反應方程式為:____。
(4)若考慮綠色化學工藝,在濾渣E中加入稀硫酸和試劑Y制膽礬晶體,試劑Y為H2O2,則反應④的總化學方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列有關溶液的說法不正確的是
A.Na2CO3、NaHCO3兩種鹽溶液中,離子種類相同
B.物質的量濃度相同的NH4Cl和NH4HSO4兩種溶液中,c(NH4+)前者小于后者
C.某物質的水溶液中由水電離出的c(H+)=1×10-amol/L,若a >7,則該溶液的pH為a或14-a
D.相同溫度下,0.2mol/L的醋酸溶液與0.1mol/L的醋酸溶液中c(H+)之比大于2∶1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com