
【題目】二氧化氯(ClO2)是一種優良的消毒劑,熔點為-59℃,沸點為 11℃,濃度過高時易發生分解,甚至爆炸。某課外興趣小組通過氯氣與 NaClO2溶液反應來制取少量ClO2,裝置如下圖所示:
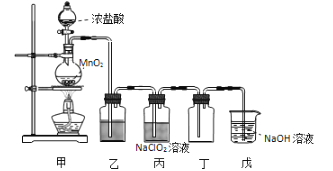
(1)甲裝置中圓底燒瓶內發生反應的化學方程式是____________________。
(2)丙裝置中發生的反應可能經兩步完成,請將其補充完整:
①____________________________________________(用化學方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在時會催化 ClO2的生成,若無乙裝置,則丙裝置內產生 ClO2的速率明顯加快。乙裝置中試劑瓶內的液體是__________。實驗過程中常需通入適量的 N2稀釋 ClO2,其目的是_______________________。
(4)戊裝置燒杯中 NaOH 溶液吸收 ClO2后,生成了 ClO2-、ClO3-,該反應的離子方程式是__________。
【答案】MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O Cl2+H2O
MnCl2+Cl2↑+2H2O Cl2+H2O![]() HCl+HClO 飽和食鹽水 防止ClO2 發生分解,甚至爆炸 2ClO2+2OH-= ClO2- +ClO3- +H2O
HCl+HClO 飽和食鹽水 防止ClO2 發生分解,甚至爆炸 2ClO2+2OH-= ClO2- +ClO3- +H2O
【解析】
(1)甲裝置中是MnO2和HCl(濃)反應制氯氣的。
(2)丙裝置中氯氣先和水反應,反應的化學方程式為Cl2+H2O![]() HCl+HClO。
HCl+HClO。
(3)從甲裝置中出來的氯氣中混有氯化氫,氯氣在飽和食鹽水中不溶,氯化氫溶解在水中。
(4)根據元素守恒和電荷守恒配平離子方程式。
(1)甲裝置中是MnO2和HCl(濃)反應制氯氣的,圓底燒瓶內發生反應的化學方程式是:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,故答案為:MnO2+4HCl(濃)
MnCl2+Cl2↑+2H2O,故答案為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)丙裝置中氯氣先和水反應,反應的化學方程式為Cl2+H2O![]() HCl+HClO,故答案為:Cl2+H2O
HCl+HClO,故答案為:Cl2+H2O![]() HCl+HClO。
HCl+HClO。
(3)從甲裝置中出來的氯氣中混有氯化氫,氯氣在飽和食鹽水中不溶,氯化氫溶解在水中,故乙裝置中試劑瓶內的液體是飽和食鹽水,通入適量的 N2稀釋 ClO2,其目的是防止ClO2 發生分解,甚至爆炸,故答案為:飽和食鹽水;防止ClO2 發生分解,甚至爆炸。
(4)戊裝置燒杯中NaOH溶液吸收 ClO2后,生成了 ClO2-、ClO3-,根據元素守恒可知產物還有水生成,再根據電荷守恒可得出該反應的離子方程式是:2ClO2+2OH-= ClO2- +ClO3- +H2O,故答案為:2ClO2+2OH-= ClO2- +ClO3- +H2O。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】等質量的甲、乙、丙三種金屬,分別與足量的溶質質量分數相同的稀硫酸完全反應后,都生成+2價的硫酸鹽,其產生氫氣的體積與反應時間的關系如圖所示,則下列說法正確的是
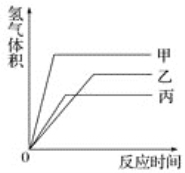
A. 三種金屬的活動性順序為甲>乙>丙
B. 反應結束消耗硫酸的質量一定相同
C. 三種金屬的相對原子質量是甲>乙>丙
D. 甲先反應完,乙最后反應完
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)如圖為CO2分子晶體結構的一部分,觀察圖形。試說明每個 CO2分子周圍有________個與之緊鄰且等距的 CO2分子;該結構單元平均占有________個CO2分子。

(2)在40 GPa高壓下,用激光器加熱到1800 K時,人們成功制得原子晶體干冰,其結構和性質與SiO2原子晶體相似,下列說法正確的是________。
A.原子晶體干冰易升華,可用作制冷劑
B.原子晶體干冰有很高的熔點和沸點
C.原子晶體干冰的硬度小,不能用作耐磨材料
D.原子晶體干冰在一定條件下可與氫氧化鈉反應
E.每摩爾原子晶體干冰中含有4 mol C—O鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求進行填空:
(1)6.20 g Na2O 晶體中含 Na+的物質的量是 _________________。
(2)等質量的 NH3 和 H2S 中,氫原子的個數比是______________________。
(3) 鐵與水蒸氣反應的化學方程式_______________________________________。
(4) 向少量氯化鋁溶液中加入足量氫氧化鈉的離子方程式________________________。
(5)人通過呼吸作用吸入氧氣,氧化體內的葡萄糖(C6H12O6)提供能量以維持生命活動,反應式為:C6H12O6+6O26CO2+6H2O+能量,該反應中的還原劑是______,若在該反應中消耗氧化劑的體積在標準狀況下為4.48L,則反應中轉移電子的物質的量為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常通過高溫分解FeSO4的方法制備Fe2O3,其化學方程式為:2FeSO4![]() Fe2O3+SO2↑+SO3↑為檢驗FeSO4高溫分解的產物,進行如下實驗
Fe2O3+SO2↑+SO3↑為檢驗FeSO4高溫分解的產物,進行如下實驗
(1)檢驗產物Fe2O3取少量FeSO4高溫分解得到的固體,加入一定量__________溶解,再向該溶液中加入適量的__________溶液,如有____________現象產生,則證明產物中存在Fe2O3
(2)檢驗氣體產物:將FeSO4高溫分解產生的氣體通入下圖三個裝置中,以檢驗產生的氣體中是否含有SO2、SO3。
①三個裝量的連接序為_______________(填裝置序號)
②實驗中如觀察到裝置A中品紅溶液______,裝置B BaCl2溶液中__________,則可證明FeSO4高溫分解產生的氣體中含有SO2、SO3。
③裝置C中NaOH溶液的作用是_______________(用離子方程式表示〕。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:2NO2![]() 2NO+O2在體積固定的密閉容器中進行,達到平衡狀態的標志是
2NO+O2在體積固定的密閉容器中進行,達到平衡狀態的標志是
①單位時間內生成nmolO2的同時消耗2nmolNO2
②單位時間內生成nmolO2的同時消耗2nmolNO
③用NO2、NO、O2表示的反應速率之比為2∶2∶1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的壓強不再改變的狀態
⑦混合氣體的平均相對分子質量不再改變的狀態
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于分散系的說法中正確的是( )
A.不能發生丁達爾效應的分散系有氯化鈉溶液、水等
B.可吸入顆粒(例如硅酸鹽粉塵)形成氣溶膠,對人類健康的危害更大
C.膠體的分散質粒子的直徑為1~10 nm
D.氯化鐵溶液與氫氧化鐵膠體的本質區別是有無丁達爾效應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.摩爾是國際單位制中七個基本物理量之一
B.常溫常壓下,11.2LCO2所含分子數為0.5NA
C.H2SO4 的摩爾質量為98 g
D.6.02×1022個H2SO4分子的質量為9.8 g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com