
【題目】(1)如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
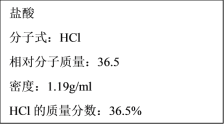
①該濃鹽酸的物質的量濃度為___mol·L-1。
②某學生欲用上述濃鹽酸和蒸餾水配制480ml物質的量濃度為0.4mol·L-1的稀鹽酸,該學生需用量筒量取___mL上述濃鹽酸進行配制,所需用的儀器除量筒、燒杯、膠頭滴管和玻璃棒之外,還需要___。
(2)KClO3與濃鹽酸在一定溫度下反應會生成黃綠色的易爆物質二氧化氯,其變化可表述為:KClO3+HCl(濃)―KCl+ClO2↑+Cl2↑+
①請完成該化學方程式(將配平后的完整化學方程式寫在答題卡上)___。
②濃鹽酸在反應中顯示出來的性質是__(填寫編號)。
A.只有還原性 B.還原性和酸性 C.只有氧化性 D.氧化性和酸性
③若標況下產生了2.24LCl2,則生成ClO2的質量為__g。
④在KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O中,若標況下產生了6.72LCl2,則轉移的電子數目為___。
【答案】11.9 16.8 500mL容量瓶 2KClO3+4HCl(濃)=2KCl+2ClO2↑+Cl2↑+2H2O B 13.5 0.5NA(或者3.01×1023)
【解析】
(1)①c=![]() =
=![]() =11.9mol/L;
=11.9mol/L;
②配制480ml物質的量濃度為0.4mol·L-1的稀鹽酸,應選用500mL的容量瓶,根據c1×V1= c2×V2,0.4mol·L-1×0.5L=11.9mol/L×V,則V=16.8mL;根據實驗步驟,需要的儀器有500mL容量瓶、燒杯、量筒、玻璃棒、膠頭滴管;
(2)①根據價態“只靠攏不相交”的原則,+5價的Cl變為+4價,-1價的Cl變為0價,利用得失電子守恒;
②濃鹽酸在反應中Cl的化合價升高,表現還原性,與硝酸鉀反應生成鹽和水,則表現酸性;
③根據n(ClO2):n(Cl2)=2:1,m=nM進行計算;
④KClO3中的Cl的化合價由+5變為0價,得5個電子,生成3個Cl2。
(1)①c=![]() =
=![]() =11.9mol/L;
=11.9mol/L;
②配制480ml物質的量濃度為0.4mol·L-1的稀鹽酸,應選用500mL的容量瓶,根據c1×V1= c2×V2,0.4mol·L-1×0.5L=11.9mol/L×V,則V=16.8mL;根據實驗步驟,需要的儀器有500mL容量瓶、燒杯、量筒、玻璃棒、膠頭滴管;
(2)①根據價態“只靠攏不相交”的原則,+5價的Cl變為+4價,-1價的Cl變為0價,利用得失電子守恒,則方程式為2KClO3+4HCl(濃)=2KCl+2ClO2↑+Cl2↑+2H2O;
②濃鹽酸在反應中Cl的化合價升高,表現還原性,與硝酸鉀反應生成鹽和水,則表現酸性,答案為B;
③n(ClO2):n(Cl2)=2:1,標況下產生了2.24LCl2,即0.1mol,則生成生成ClO2的物質的量為0.2mol,則m=nM=0.2×67.5=13.5g;
④KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O中,KClO3中的Cl的化合價由+5變為0價,得5個電子,生成3個Cl2,若標況下產生了6.72LCl2,即0.3mol時,轉移0.5mol電子,即0.5NA。


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源: 題型:
【題目】室溫下,2H2(g)+O2(g)![]() 2H2O(l)+566kJ。下列說法錯誤的是
2H2O(l)+566kJ。下列說法錯誤的是
A.H2![]() H+H的過程需要吸熱
H+H的過程需要吸熱
B.若生成2mol水蒸氣,則放出的熱量大于566kJ
C.2g氫氣完全燃燒生成液態水所釋放的能量為283kJ
D.2mol氫氣與1mol氧氣的能量之和大于2mol液態水的能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加碘食鹽是含KIO3的食鹽,其中KIO3可由反應KI+3Cl2+3H2O=KIO3+6HCl制取。市面上銷售的加碘食鹽中的碘元素含量為20~50mg/kg。請計算:制取1000kg含碘元素25.4mg/kg的加碘食鹽,需要消耗Cl2的體積是多少___?(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某一反應體系中有反應物和生成物共5種物質:H2S+HNO3→S+NO+H2O;下列說法中正確的是( )
A.該反應中的還原產物是S
B.若反應過程中轉移了0.3 mol 電子,則氧化產物的質量9.6g
C.氧化劑與還原劑的物質的量之比為2∶3
D.反應后溶液的酸性明顯增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用CaSO4代替O2與燃料CO反應,既可以提高燃燒效率,又能得到高純CO2,是一種高效、清潔、經濟的新型燃燒技術,反應①為主反應,反應②和③為副反應。
①1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g) ![]() CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)![]() 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反應2 CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=_______________(用△H1、△H2和△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=_______________(用△H1、△H2和△H3表示)。
(2)為減少副產物,獲得更純凈的CO2,可在初始燃料中適量加入__________________。
(3)以反應①中生成的CaS為原料,在一定條件下經原子利用率100%的高溫反應,可再生成CaSO4,該反應的化學方程式為___________;在一定條件下CO2可與對二甲苯反應,在其苯環上引入一個羧基,產物的結構簡式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A.碳酸氫鈉溶液與少量石灰水反應HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
B.氯化銨與氫氧化鈉兩種濃溶液混合加熱OH﹣+NH4+![]() H2O+NH3↑
H2O+NH3↑
C.氫氧化鐵與稀硫酸反應H++OH﹣=H2O
D.單質銅與稀硝酸反應Cu+2H++2NO3﹣=Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含有11.2 g KOH的稀溶液與1 L 0.1 molL﹣1的H2SO4溶液反應,放出11.46 kJ的熱量,下列熱化學方程式正確的是
A. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
B. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =-11.46 kJmol﹣1
C. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =+114.6 kJmol﹣1
D. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用Na2O2與H2O反應快速制取少量O2.用下面裝置制取O2并演示Na在O2中的燃燒實驗.
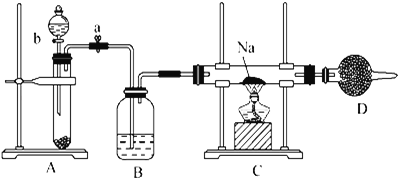
請回答下列問題:
(1)寫出A裝置中反應的化學方程式_____.
(2)B裝置中盛放的試劑是_____.
(3)D裝置中盛放的試劑是_____,其作用是_____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電浮選凝聚法是工業上采用的一種污水處理方法,即保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3膠體,Fe(OH)3膠體具有吸附作用,可吸附水中的污物而使其沉淀下來,起到凈水的作用,其原理如圖所示。下列說法正確的是

A. 石墨電極上發生氧化反應
B. 根據圖示,物質A為CO2
C. 為增強污水的導電能力,可向污水中加入適量乙醇
D. 甲烷燃料電池中CO32-向空氣一極移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com