
【題目】鎂及其化合物用途非常廣泛,目前世界上60%的鎂是從海水中提取.從海水中先將海水淡化獲得淡水和濃海水,濃海水的主要成分如下:
離子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
濃度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用濃海水提鎂的一段工藝流程如下圖:
請回答下列問題
(1)濃海水主要含有的四種離子中物質的量濃度最小的是 . 在上述流程中,可以循環使用的物質是 .
(2)在該工藝過程中,X試劑的化學式為 .
(3)“一段脫水”目的是制備MgCl22H2O;“二段脫水”的目的是制備電解原料.若將MgCl26H2O直接加熱脫水,則會生成Mg(OH)Cl.若電解原料中含有Mg(OH)Cl,電解時Mg(OH)Cl與陰極產生的Mg反應,使陰極表面產生MgO鈍化膜,降低電解效率.生成MgO的化學方程式為 .
(4)若制得Mg(OH)2的過程中濃海水的利用率為80%,由Mg(OH)2至“二段脫水”制得電解原料的過程中鎂元素的利用率為90%,則1m3濃海水可得“二段脫水”后的電解原料質量為g.
(5)以LiCl﹣KCl共熔鹽為電解質的Mg﹣V2O5電池是戰術導彈的常用電源,該電池的總反應為:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 該電池的正極反應式為 .
(6)Mg合金是重要的儲氫材料.2LiBH4/MgH2體系放氫焓變示意圖如下,則: Mg(s)+2B(s) MgB2(s)△H= . 
【答案】
(1)SO42﹣;Cl2、HCl
(2)CaCl2
(3)2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑
(4)82080
(5)V2O5+2Li++2e﹣=V2O4?Li2O
(6)﹣93kJ/mol
【解析】解:濃海水加入氯化鈣,可生成硫酸鈣,一達到脫硫的目的,加入熟石灰,可生成氫氧化鎂,進而生成MgCl26H2O,一段脫水生成MgCl22H2O,在通入HCl的氛圍中加入氯化鎂溶液得到氯化鎂,電解可得到鎂和氯氣,(1)由表中數據c(Na+)= ![]() =2.77mol/L,c(Mg2+)=
=2.77mol/L,c(Mg2+)= ![]() =1.2mol/L,c(Cl﹣)=
=1.2mol/L,c(Cl﹣)= ![]() =4.07mol/L,c(SO42﹣)=
=4.07mol/L,c(SO42﹣)= ![]() =0.48mol/L,故SO42﹣的物質的量濃度最小,上述流程中氯氣和與氫氣反應生成氯化氫,氯化氫可與氫氧化鎂反應制備氯化鎂,則可循環的是Cl2、HCl,所以答案是:SO42﹣;Cl2、HCl;(2)X為氯化鈣,可生成硫酸鈣,一達到脫硫的目的,所以答案是:CaCl2;(3)由題意知Mg(OH)Cl與陰極產生的Mg反應,產生MgO,反應的化學方程式為2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑,所以答案是:2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑;(4)由題給數據可知1m3濃海水含有m(Mg2+)=1000L×28.8g/L,n(Mg2+)=
=0.48mol/L,故SO42﹣的物質的量濃度最小,上述流程中氯氣和與氫氣反應生成氯化氫,氯化氫可與氫氧化鎂反應制備氯化鎂,則可循環的是Cl2、HCl,所以答案是:SO42﹣;Cl2、HCl;(2)X為氯化鈣,可生成硫酸鈣,一達到脫硫的目的,所以答案是:CaCl2;(3)由題意知Mg(OH)Cl與陰極產生的Mg反應,產生MgO,反應的化學方程式為2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑,所以答案是:2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑;(4)由題給數據可知1m3濃海水含有m(Mg2+)=1000L×28.8g/L,n(Mg2+)= ![]() mol,則生成Mg(OH)2的物質的量為
mol,則生成Mg(OH)2的物質的量為 ![]() mol×80%,經二段脫水生成MgCl2的物質的量為
mol×80%,經二段脫水生成MgCl2的物質的量為 ![]() ×80%×90%,質量為
×80%×90%,質量為 ![]() mol×80%×90%×95g/mol=82080g,所以答案是:82080;(5)正極發生還原反應,V2O5被還原生成V2O4Li2O,電極方程式為V2O5+2Li++2e﹣=V2O4Li2O,所以答案是:V2O5+2Li++2e﹣=V2O4Li2O;(6)由圖可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJmol﹣1① 2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJmol﹣1②
mol×80%×90%×95g/mol=82080g,所以答案是:82080;(5)正極發生還原反應,V2O5被還原生成V2O4Li2O,電極方程式為V2O5+2Li++2e﹣=V2O4Li2O,所以答案是:V2O5+2Li++2e﹣=V2O4Li2O;(6)由圖可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJmol﹣1① 2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJmol﹣1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJmol﹣1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200﹣183)kJmol﹣1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJmol﹣1④
所以﹣④﹣②得:Mg(s)+2B(s)═MgB2(s)△H=﹣(17+76)kJmol﹣1=﹣93kJmol﹣1 ,
所以答案是:﹣93kJmol﹣1 .
【考點精析】關于本題考查的反應熱和焓變,需要了解在化學反應中放出或吸收的熱量,通常叫反應熱才能得出正確答案.


科目:高中化學 來源: 題型:
【題目】下列各組化合物中,化學鍵類型完全相同的是:( )
A. HCl 和NaOHB. Na2O 和Na2O2
C. CO2和 CaOD. CaCl2和 Na2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)是環保部門監測有害氣體常用的一種藥品,它易溶于水,遇酸易分解。某實驗室模擬工業硫化堿法制取硫代硫酸鈉,其反應裝置及所需試劑如圖。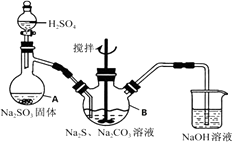
實驗具體操作步驟為:
①打開分液漏斗使硫酸慢慢滴下,適當調節分液漏斗的滴速,使反應產生的SO2氣體較均勻的通入Na2S和Na2CO3的混合溶液中,同時開啟電動攪拌器攪動,水浴加熱,微沸。
②直至析出的渾濁不再消失,并控制溶液的pH接近7時,停止通入SO2氣體。
(1)寫出儀器A的名稱。
(2)寫出A中發生反應的化學方程式。
(3)為了保證硫代硫酸鈉的產量,實驗中通入的SO2不能過量,原因是。
(4)Na2S2O3常用作脫氯劑,在溶液中易被Cl2氧化成SO42離子,該反應的離子方程式為。
(5)為了驗證固體硫代硫酸鈉工業產品中含有碳酸鈉,選用下圖裝置進行實驗。
①實驗裝置的連接順序依次是(填裝置的字母代號),裝置C中的試劑為。
②能證明固體中含有碳酸鈉的實驗現象是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃時,CH4與N2在不同物質的量之比[ ![]() ]時CH4的平衡轉化率如圖所示.下列說法正確的是( )
]時CH4的平衡轉化率如圖所示.下列說法正確的是( ) 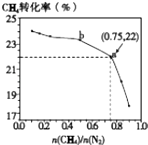
A.![]() 越大,CH4的轉化率越高
越大,CH4的轉化率越高
B.![]() 不變時,若升溫,NH3的體積分數會增大
不變時,若升溫,NH3的體積分數會增大
C.b點對應的平衡常數比a點的大
D.a點對應的NH3的體積分數約為26%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用NaClO3制取ClO2氣體,再由ClO2制得NaClO2 , 實驗裝置如圖所示:回答下列問題: 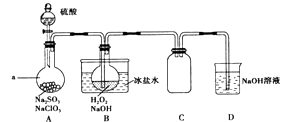
(1)儀器a的名稱為;裝置C的作用是 .
(2)該實驗必須使NaClO3稍微過量,目的是 .
(3)為使ClO2氣體能被均勻、充分吸收,操作時應注意 .
(4)NaOH吸收ClO2尾氣,生成物質的量之比為1:1的兩種陰離子,一種為ClO2﹣ , 則另一種為 .
(5)B中反應的離子方程式為 .
(6)證明NaClO2具有氧化性的方法是:將B中溶液加熱除去H2O2 , 加入(填序號,下同)酸化,再加入檢驗. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)預計NaClO3轉化為NaClO2的轉化率為80%,若要制得28.9g NaClO23H2O(相對質量:144.5),至少需g NaClO3(相對質量:106.5).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列判斷錯誤的是
A. 穩定性:H2O>NH3>CH4B. 原子半徑:N<O<F
C. 酸性:HClO4>H2SO4>H3PO4D. 堿性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化銅礦石含有CuO和難溶于水的Cu2(OH) 2CO3 , 還含有Fe2O3、FeO和SiO2等。銅、鐵是畜禽所必需的微量元素。某廠生產硫酸銅和硫酸亞鐵流程如下: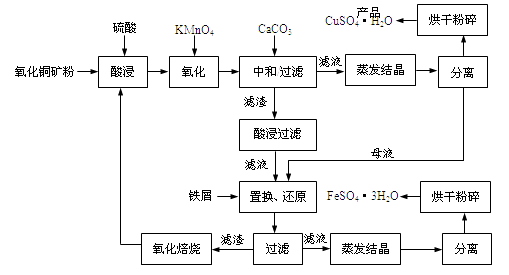
(1)氧化銅礦石粉碎的目的是,KMnO4的作用是將Fe2+氧化成Fe3+。
(2)寫出“酸浸”中Cu2(OH) 2CO3發生反應的離子方程式 。
(3)“中和/過濾”中加入CaCO3的目的是,使Fe3+ 水解成沉淀而除去。
(4)流程中多處涉及“過濾”,實驗室中過濾需要使用的玻璃儀器有燒杯、。
(5)加入鐵屑的作用是使母液中Fe3+轉化為Fe2+、。
(6)下表為硫酸銅晶體“烘干粉碎”的試驗結果。
表中m為CuSO4·5H2O晶體的質量,x為干燥后所得晶體中結晶水個數。據此可確定由CuSO4·5H2O脫水得流程所示產品的適宜工藝條件為(指出條件的溫度和時間)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(17分)羥甲香豆素是一種治療膽結石的藥物,合成路線如下圖所示:


已知: 
RCOOR'+R'OH ![]() RCOOR'+ R'OH(R、R'、R'代表烴基)
RCOOR'+ R'OH(R、R'、R'代表烴基)
(1)A屬于芳香烴,其結構簡式是。B中所含的官能團是。
(2)C→D的反應類型是。
(3)E屬于脂類。僅以乙醇為有機原料,選用必要的無機試劑合成E,寫出有關化學方程式:。
(4)已知:2E ![]() F+C2H5OH。F所含官能團有
F+C2H5OH。F所含官能團有 ![]() 和。
和。
(5)以D和F為原料合成羥甲香豆素分為三步反應,寫出有關化合物的結構簡式:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com