
【題目】實驗測得標準狀況下某氣體的密度為1.97 g/L,則該氣體的相對分子質量是( )
A. 16 B. 28 C. 44 D. 48
 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,將濃度都是0.1mol·L-1的X2、Y2兩種氣體充入至密閉容器中,使之發生反應生成氣體Z,達到平衡時c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,則該反應的反應式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應的離子方程式正確的是( )
A. 將少量![]() 通入
通入![]() 溶液中:
溶液中:![]()
B. 向稀氨水中通入少量![]() :
:![]()
C. 用稀![]() 溶解FeS固體:
溶解FeS固體:![]()
D. 將醋酸滴入硅酸鈉溶液中:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室中保存下列化學藥品的方法正確的是( )
A.硝酸銀晶體保存在棕色試劑瓶中B.固體燒堿保存在橡膠塞細口試劑瓶中
C.白磷保存在玻璃塞廣口瓶中D.濃鹽酸可存放在敞口容器中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各示意圖與對應的表述正確的是( )
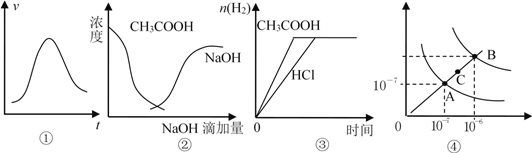
A. 圖①表示一定條件下某化學反應的速率隨時間變化的趨勢圖,該反應一定為放熱反應
B. 圖②中曲線表示將氫氧化鈉溶液滴加到醋酸溶液濃度的變化趨勢圖
C. 圖③表示等體積、等物質的量濃度的鹽酸和醋酸溶液,分別加入足量鎂粉,產生H2的物質的量的變化
D. 圖④為水的電離平衡曲線圖,若從A點到C點,可采用在水中加入適量NaOH固體的方法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高聚合物G、I 可用于生產全生物降解塑料, 在“白色污染”日益嚴重的今天有著重要的作用。有關轉化關系如下:

已知:①CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr;②H的分子中有一個含“—O—”結構的三元環;③含有“
CH3CH2CH2OH+NaBr;②H的分子中有一個含“—O—”結構的三元環;③含有“![]() ”結構的有機物分子不能穩定存在。
”結構的有機物分子不能穩定存在。
請回答下列問題:
(1)寫出H的結構簡式_____________。
(2)下列說法不正確的是_______________。
A.化合物G、I屬于酯類
B.物質A可以發生中和反應
C.1mol D與足量Na反應放出1molH2
D.B和氯氣在一定條件可以發生加成生成C3H5Cl
(3)寫出由兩分子 F合成六元環化合物的化學方程式_________。
(4)化合物F有多種同分異構體,寫出符合下列條件F的同分異構體的結構簡式_____________。
①能和NaOH反應;②能發生銀鏡反應
(5)依據上述合成路線,設計以乙烯為原料制備乙二醛(![]() )的合成路線(無機原料任意選擇,合成路線用流程圖表示)__________________。合成路線流程圖示列:
)的合成路線(無機原料任意選擇,合成路線用流程圖表示)__________________。合成路線流程圖示列:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等物質的量的Na和Na2O2分別與足量的水反應,生成的氣體在同溫同壓下的體積之比為( )
A. 1:1 B. 1:2 C. 2:1 D. 2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸(H2C2O4)溶液與酸性KMnO4溶液反應時,溶液褪色總是先慢后快,某學習小組探究反應過程中使褪色加快的主要原因,過程如下:
【查閱資料】KMnO4溶液氧化H2C2O4的反應歷程為:
![]()
【提出假設】假設1:該反應為放熱反應
假設2:反應生成的Mn2+對該反應有催化作用
假設3:K+對該反應有催化作用
該小組同學未提出濃度使反應速率加快的假設,原因是 。
【設計、完成實驗】(1)稱取 g草酸晶體(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述過程中必須用到的2種定量儀器是托盤天平和 。
②下列操作會使所配溶液濃度偏低的是 (填下列選項的字母序號)。
A.稱取草酸晶體時,將草酸晶體放在托盤天平右盤 |
B.定容時俯視刻度線 |
C.將燒杯中溶液轉移到容量瓶之前,容量瓶中有少量蒸餾水 |
D.搖勻后,發現溶液液面低于刻度線,立即用膠頭滴管加水再定容 |
(2)完成探究,記錄數據
實驗 | 燒杯中所加試劑及用量(mL) | 控制條件 | 溶液褪色時間(s) | |||
0.10 mol/L | 等濃度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制溫度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固體 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
則x = ,假設2成立
(3)由于KMnO4能氧化水中有機物等因素,為配制好穩定的KMnO4溶液,其濃度需標定。取10.00 mL 0.10 mol/L H2C2O4溶液于錐形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至錐形瓶中恰好呈淺紫色,且半分鐘不褪色,記錄數據,平行三次實驗,平均消耗KMnO4溶液40.00 mL,則草酸溶液與酸性KMnO4溶液反應的離子方程式為: 。上述實驗中KMnO4溶液的物質的量濃度為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com