
某化學課外興趣小組為探究銅跟濃硫酸的反應情況,用下圖所示裝置先進行了有關實驗:
(1)B是用來收集實驗中產生的氣體的裝置,但未將導管畫全,請在圖上把導管補充完整。
(2)實驗中他們取6.4g 銅片和12mL 18mol·L-1濃硫酸放在圓底燒瓶中共熱,直到反應完畢,最后發現燒瓶中還有銅片剩余,該小組學生根據所學的化學知識認為還有一定量的硫酸剩余。
①寫出銅跟濃硫酸反應的化學方程式 。
②為什么有一定量的余酸但未能使銅片完全溶解,你認為原因是 。
③下列藥品中能夠用來證明反應結束后的燒瓶中確有余酸的是 (填寫編號)。
A.鐵粉 B.氯化鋇溶液 C.銀粉 D.碳酸氫鈉溶液
(3)為定量測定余酸的物質的量濃度,甲、乙學生進行了如下設計:
①甲同學設計方案是:先測定銅與濃硫酸反應產生的SO2的量,在計算余酸的物質的量濃度。他認為測定二氧化硫的量的方法有多種,請問下列實驗方案中可行的是 (填寫編號)。
A.將裝置A產生的氣體緩緩通過預先稱量過的盛有堿石灰的干燥管,結束反應后再次稱量
B.將裝置A產生的氣體緩緩通入足量用稀硫酸酸化的高錳酸鉀溶液,再加入足量氯化鋇溶液,過濾、洗滌、干燥、稱量沉淀
C.用排水法測定裝置A產生氣體的體積(已折算成標準狀況)
D.將裝置A產生的氣體緩緩通入足量氫氧化鋇溶液,反應完全后,過濾、洗滌、干燥、稱量沉淀
E.將裝置A產生的氣體緩緩通入足量硝酸酸化的硝酸鋇溶液,反應完全后,過濾、洗滌、干燥、稱量沉淀
請你對不可行的方案進行分析(可以不填滿):
| 方案序號 | 分析 | 誤差(偏低或偏高) | 改變措施 |
| | | | |
| | | | |
| | | | |
| | | | |
(1)如圖所示。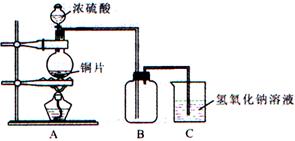 (2分)
(2分)
(2)①Cu + 2H2SO4(濃) CuSO4 + SO2↑+ 2H2O(2分)
CuSO4 + SO2↑+ 2H2O(2分)
②隨著反應進行,硫酸被消耗,產物有水生成,所以濃硫酸變成稀硫酸,反應會停止(1分)
③AD(1分)
(3)①E(1分)
②不能(1分) 雖然甲基橙變色范圍:pH為3.1~4.4,氫氧化銅開始沉淀時的pH為5,在指示劑變色范圍之外,即中和酸時,銅離子不會消耗OH-,但是甲基橙由紅色變成橙色、黃色時,銅離子溶液呈藍色,對觀察指示終點顏色有干擾。(1分)方案序號 分析 誤差(偏低或偏高) 改變措施 A 堿石灰除吸收二氧化硫外還能吸收水,測得二氧化硫質量增大 偏低 A產生的氣體先經濃硫酸干燥,后用堿石灰吸收 B 高錳酸鉀溶液中含有硫酸,與氯化鋇反應生成沉淀增大 偏低 將硫酸酸化的高錳酸鉀溶液換成溴水或碘水或硝酸溶液 C 二氧化硫在水中以1∶40溶解,收集二氧化硫體積減少 偏高 將水換成四氯化碳、煤油等非極性溶劑 D 亞硫酸鋇在空氣中烘干及稱重過程中部分被氧化生成硫酸鋇,產生固體質量增大 偏低 先將二氧化硫用強氧化劑如溴水氧化,再加入足量的氯化鋇溶液或氫氧化鋇溶液
(4)(2分)
方案一:①取反應后溶液,向其中加入足量鋅;②收集并測定氫氣的體積;③通過氫氣量計算剩余硫酸的物質的量濃度。
方案二:①取反應后溶液,向其中加入過量的氫氧化鈉溶液,至氫氧化銅完全沉淀;②過濾、洗滌、(低溫)干燥、稱量至恒重;③根據氫氧化銅的量計算出已反應的硫酸的量,進而計算剩余硫酸溶液濃度。
方案三:反應結束后將燒瓶中的銅片取出,洗凈、烘干,稱其質量即可。
方案四:反應結束后將燒瓶中的銅片取出,然后向溶液中加入足量氯化鋇溶液,過濾出沉淀,洗凈、干燥后稱量。(只要合理即得2分)
解析


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 某化學課外興趣小組為探究銅跟濃硫酸的反應情況,用圖所示裝置進行有關實驗.請回答:
某化學課外興趣小組為探究銅跟濃硫酸的反應情況,用圖所示裝置進行有關實驗.請回答:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 某化學課外興趣小組為探究苯與溴發生反應的反應類型并制取純凈的溴苯,進行如下實驗.請根據要求回答相關問題.
某化學課外興趣小組為探究苯與溴發生反應的反應類型并制取純凈的溴苯,進行如下實驗.請根據要求回答相關問題.

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com