【答案】硫酸 2MnO4- + 5H2C2O4 + 6H+= 2Mn2+ + 10CO2↑ + 8H2O 溫度 催化劑 0.5 酸性KMnO4溶液褪色的時間 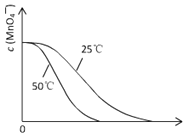
【解析】
(1)酸性的KMnO4溶液有強氧化,不能選擇還原性的酸酸化;H2C2O4溶液和酸性KMnO4溶液反應生成二氧化碳、錳離子和水;
(2)實驗①②是在相同濃度,不使用催化劑,不同溫度下進行的實驗探究;而實驗②④是在相同濃度、相同溫度,是否使用催化劑條件下進行的實驗探究;上述實驗②③是探究濃度對化學反應速率的影響,則混合液的總體積必須相同;反應速率需要通過時間的快慢來體現;
(3)根據溫度降低反應速率減小畫出25℃時c(MnO4-)~t的變化曲線示意圖。
(1)酸性的KMnO4溶液有強氧化,不能選擇還原性的酸酸化,也不能選擇強氧化性的酸如硝酸酸化,只能選擇稀硫酸酸化;H2C2O4溶液和酸性KMnO4溶液反應生成二氧化碳、錳離子和水,則反應的化學方程式為2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,離子方程式為2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
(2)實驗①②是在相同濃度,不使用催化劑的條件下進行的,但反應溫度不同,則為探究溫度對速率的影響;而實驗②④是在相同濃度、相同溫度的條件下進行的,但②不使用催化劑,而④使用催化劑,則為探究催化劑對反應速率的影響;上述實驗②③是探究濃度對化學反應速率的影響,則混合液的總體積必須相同,實驗②溶液總體積為6mL,則實驗③中所需水的體積a=6mL-1.5mL-4.0mL=0.5mL;反應速率需要通過時間的快慢來體現,則乙中需要測量的是KMnO4溶液褪色所需時間;
(3)25℃時反應速率小于50℃時,所以高錳酸根離子的濃度變化比50℃時小,反應需要的時間大于50℃條件下需要的時間,據此畫出25℃時c(MnO4-)~t的變化曲線示意圖為: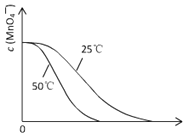 。
。
