
【題目】下列實驗操作過程中不需要使用兩開門圓底燒瓶的是
A.過濾 B.蒸餾 C.溶解 D.分液
科目:高中化學 來源: 題型:
【題目】常溫下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH隨滴入HCl溶液體積的變化曲線如圖所示。下列說法正確的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三點所示的溶液中水的電離程度②>③>①
D. 滴定過程中不可能出現:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某一元弱酸(用HA表示)在水中的電離方程式是:HA![]() H++A﹣,回答下列問題:
H++A﹣,回答下列問題:
(1)向溶液中加入適量NaA固體,以上平衡將向______(填“正”、“逆”)反應方向移動。
(2)若向溶液中加水稀釋,以上平衡將向_______(填“正”、“逆”)反應方向移動,溶液中c(A﹣)將____(填“增大”、“減小”或“不變”),溶液中c(OH﹣)將____(填“增大”、“減小”或“不變”)。
(3)已知室溫時,0.1mol·L﹣1的某一元酸HA在水中有 0.1% 發生電離,回答下列各問題:
①該溶液的pH=_______。
②HA的電離平衡常數K=________。
③NaA溶液顯堿性的原因:_____________________________(用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下發生反應:2A(g)+2B(g)xC(g)+2D(g),在2L密閉容器中,把4molA和2molB混合,2min后達到平衡時生成1.6molC,又測得反應速率VD=0.2mol/(Lmin),下列說法正確的是( )
A.A和B的轉化率均是20%
B.x=4
C.平衡時A的物質的量為2.8mol
D.平衡時氣體壓強比原來減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下向10 mL pH=3的醋酸溶液中加水稀釋后,下列說法正確的是( )
A. 溶液中導電粒子的數目減少
B. 溶液中![]() 不變
不變
C. 醋酸的電離程度增大,c(H+)亦增大
D. 再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組運用電化學原理合成氨,其裝置結構如圖所示。下列有關說法不正確的是

A. 放電時,b極表面H2和CO均被氧化
B. 該電池工作時,H+由b極區遷移至a極區
C. a極的電極反應為N2+6H++6e-=2NH3
D. b極區發生反應CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中加入A,B兩種氣體,保持一定溫度,在t1、t2、t3、t4時刻測得各物質的濃度如下:據此下列結論中正確的是( )
測定時刻/s | t1 | t2 | t3 | t4 |
C(A)/molL﹣1 | 6 | 3 | 2 | 2 |
C(B)/molL﹣1 | 5 | 3.5 | 3 | 3 |
C(C)/molL﹣1 | 1 | 2.5 | 3 | 3 |
A.在容器中發生的反應為2A(g)+B(g)2C(g)
B.該溫度下,此反應的平衡常數為0.25
C.A的轉化率比B轉化率的低
D.在t3時刻反應已經停止
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質的分離或提純,應選用下述方法的哪一種(填序號)
A.分液 B.過濾 C.萃取 D.蒸餾 E.蒸發結晶 F.加熱分解
(1)除去CaCl2溶液中的CaCO3 ________。(2)從碘水中提取碘________。
(3)用自來水制取蒸餾水 _________。(4)分離植物油和水______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有陽離子交換膜、陰離子交換膜、石墨電極和如圖所示的電解槽。用氯堿工業中的離子交換膜技術原理,可電解Na2SO4溶液生產NaOH溶液和H2SO4溶液。下列說法中正確的是
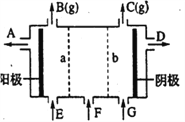
A. b是陰離子交換膜,允許Na+通過
B. 從A口出來的是H2SO4溶液
C. 陰極反應式為 4OH--4e-=2H2O+O2↑
D. Na2SO4溶液從G口加入
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com