
【題目】能源、環境與生產生活和社會發展密切相關。
一定溫度下,在兩個容積均為2 L的密閉容器中,分別發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相關數據如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相關數據如下:
容器 | 甲 | 乙 |
反應物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡時c(CH3OH) | c1 | c2 |
平衡時能量變化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)該反應的平衡常數表達式為K=____;若甲中反應10 s 時達到平衡,則0~10 s內甲中的平均反應速率v(H2)=______。
(3)下列情況能說明該反應一定達到平衡狀態的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 氣體的密度不再隨時間改變
c. CO2和CH3OH的濃度之比不再隨時間改變 d. 氣體的平均相對分子質量不再隨時間改變
【答案】 = 19.6 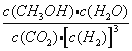 0.09 mol·L-1·s-1 cd
0.09 mol·L-1·s-1 cd
【解析】本題主要考查化學平衡的移動。
(1)容器甲、乙建立相同平衡狀態,故c1=c2,a=49.0-29.4=19.6。
(2)該反應的平衡常數表達式為K=![]() ;若甲中反應10s時達到平衡,則0~10s內甲中的平均反應速率v(H2)=3mol×29.4/49.0/2.0L/10s=0.09 mol·L-1·s-1。
;若甲中反應10s時達到平衡,則0~10s內甲中的平均反應速率v(H2)=3mol×29.4/49.0/2.0L/10s=0.09 mol·L-1·s-1。
(3)a. v(CO2)消耗、v(CH3OH)生成都是正反應速率,故a不能說明該反應一定達到平衡狀態;b. 氣體的質量、體積不變,所以氣體的密度一直保持不變,故b不能說明該反應一定達到平衡狀態;c. CO2和CH3OH的濃度之比隨著反應進行而改變,當CO2和CH3OH的濃度之比不再隨時間改變時,說明反應達到平衡狀態,故c能說明該反應一定達到平衡狀態;d. 該反應氣體物質的量有變化,氣體質量守恒,氣體的平均相對分子質量隨著反應進行而改變,當氣體的平均相對分子質量不再隨時間改變時,說明反應達到平衡狀態,故d能說明反應該反應一定達到平衡狀態。故選cd。


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:
【題目】研究化學反應的熱效應有利于更好的利用化學能。下列說法正確的是( )
A.放熱反應任何條件下一定能自發進行
B.升高溫度可以增加分子的活化能
C.生成物總能量高于反應物總能量的反應為放熱反應
D.生成物的鍵能總和大于反應物的鍵能總和的反應為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將氫氧化鈉溶液和硫酸銅溶液加入某病人的尿液中,加熱時如果發現有磚紅色的沉淀產生,說明該尿液中可能含有下列物質中的( )
A.醋酸B.酒精C.食鹽D.葡萄糖
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)NO2可用水吸收,相應的化學方程式為____________________。利用反應6NO2+8NH3![]() 7N2+12H2O也可處理NO2。當轉移1.2 mol電子時,消耗的NH3在標準狀況下是____L。
7N2+12H2O也可處理NO2。當轉移1.2 mol電子時,消耗的NH3在標準狀況下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定條件下,將NO2與SO2以體積比1∶2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是____(填字母)。
A.體系壓強保持不變 B.混合氣體顏色保持不變
C.SO3和NO的體積比保持不變 D.每消耗1 mol SO3的同時生成1 mol NO2
③測得上述反應平衡時NO2與SO2的體積比為1∶6,則平衡常數K=____。
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)![]() CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。
CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。
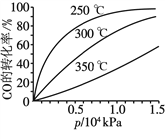
該反應的ΔH ____(填“>”或“<”)0。實際生產條件控制在250 ℃、1.3×104 kPa左右,選擇此壓強的理由是________________。
(4)煤燃燒產生的煙氣也含氮的氧化物,用CH4催化還原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
寫出CH4 催化還原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的熱化學方程式:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】10g Mg、Al合金與足量100mL NaOH溶液反應,產生H2的體積為6.72L(標準狀況下),求:
①合金中Al的質量分數;
②生成物NaAlO2的物質的量濃度(假設溶液體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常利用甲醛法測定(NH4)2SO4樣品中氮的質量分數,其反應原理為:4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定時,1 mol (CH2)6N4H+與 l mol H+相當],然后用NaOH標準溶液滴定反應生成的酸。某興趣小組用甲醛法進行了如下實驗:
步驟I 稱取樣品1.500 g。
步驟II 將樣品溶解后,完全轉移到250 mL容量瓶中,定容,充分搖勻。
步驟III 移取25.00 mL樣品溶液于250 mL錐形瓶中,加入10 mL 20%的中性甲醛溶液,搖勻、靜置5 min后,加入1~2滴酚酞試液,用NaOH標準溶液滴定至終點。按上述操作方法再重復2次。
(1)根據步驟III 填空:
①堿式滴定管用蒸餾水洗滌后,直接加入NaOH標準溶液進行滴定,則測得樣品中氮的質量分數________(填“偏高”、“偏低”或“無影響”)。
②錐形瓶用蒸餾水洗滌后,水未倒盡,則滴定時用去NaOH標準溶液的體積_______(填“偏大”、“偏小”或“無影響”)。
③滴定時邊滴邊搖動錐形瓶,眼睛應觀察____________。
(A)滴定管內液面的變化 (B)錐形瓶內溶液顏色的變化
④滴定達到終點時,酚酞指示劑由_________色變成_________色。
(2)滴定結果如下表所示:
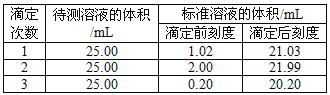
若NaOH標準溶液的濃度為0.1010 mol·L-1,則該樣品中氮的質量分數為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是
A. Na與CuSO4溶液反應:2Na+Cu2+=2Na++Cu
B. 新制氯水中:Cl2+H2O ![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
C. 200 mL 2 mol/L的FeBr2溶液中通入11.2L標準狀況下的氯氣:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-
D. 向碳酸氫鈣溶液中加入過量氫氧化鈉溶液:Ca2++HCO3-+OH-= CaCO3↓+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com