
【題目】氫氣是重要的化學試劑、化工原料和有廣闊發展前景的新能源。以甲醇為原料制備氫氣的一種原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密閉容器中充入lmolCH3OH(g),發生反應i。圖I中能正確表示CHOH(g)的平衡轉化率(a)隨溫度(T)變化關系的曲線為_______________(填“A”或“B”),理由為_____________。T1℃時,體系的平衡壓強與起始壓強之比為_________________________。

(2)起始向10L恒容密閉容器中充入lmolCH3OH(g)和1molH2O(g),發生反應i利反應ii,體系中CO的平衡體積分數與溫度(T)和壓強(p)的關系如圖2所示。
①隨著溫度升高,n(CO2)/n(CO)的值______(填“增大““減小”或“不變”),理由為____________。
②p1、p2、p3由大到小的順序為___________________。
③測得C點時、休系中CO2的物質的量為0.2mol,則T2℃時,反應ii的平衡常數K=________。
【答案】 B 反應i為吸熱反應,升高溫度,平衡正向移動,CHOH(g)的平衡轉化率增大 9:5 減小 升高溫度。反應i中CO的物質的量增大。反應ii中CO的物質的量增大、CO2的物質的量減小,最終n(CO2)/(CO)的值減小 P1>P2>P3 0.875
【解析】(1)反應iCH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1為吸熱反應,升高溫度,平衡正向移動,CHOH(g)的平衡轉化率增大,B曲線正確;由圖1可知,T1℃時,CH3OH(g)的平衡轉化率為40%,則平衡體系中CH3OH(g)、CO(g)、H2的物質的量分別為0.6mol、0.4mol、0.8mol,同溫同體積下,壓強比等于氣體物質的量之比,則體系的平衡壓強與起始壓強之比為1.8:1=9:5;(2) ①反應i為吸熱反應,升高溫度,平衡正向移動,CO的物質的量增大,反應ii為放熱反應,升高溫度,平衡逆向移動,CO的物質的量增大,CO2的物質的量減小,故溫度升高,n(CO2)/n(CO)的值減小;②反應i為氣體分子總數增大的反應,增大壓強,CO的體積分數減小,反應ii為氣體分子總數相等的反應,壓強不影響平衡,增大壓強,CO的體積分數不變,綜上所述,增大壓強,CO的體積分數減小,故P1>P2>P3;③設反應i中參加反應的CH3OH(g)的物質的量為x,則生成的CO的物質的量為x,應用差量法,反應i中氣體總物質的量增大2x,反應ii中氣體總物質的量不變,故平衡時容器內氣體總物質的量為(2+2x)mol;體系中CO2的物質的量為0.2mol,則消耗CO的物質的量為,則平衡時CO的物質的量為(x-0.2)mol,結合圖2得
CO(g)+2H2 △H =+90kJ·mol-1為吸熱反應,升高溫度,平衡正向移動,CHOH(g)的平衡轉化率增大,B曲線正確;由圖1可知,T1℃時,CH3OH(g)的平衡轉化率為40%,則平衡體系中CH3OH(g)、CO(g)、H2的物質的量分別為0.6mol、0.4mol、0.8mol,同溫同體積下,壓強比等于氣體物質的量之比,則體系的平衡壓強與起始壓強之比為1.8:1=9:5;(2) ①反應i為吸熱反應,升高溫度,平衡正向移動,CO的物質的量增大,反應ii為放熱反應,升高溫度,平衡逆向移動,CO的物質的量增大,CO2的物質的量減小,故溫度升高,n(CO2)/n(CO)的值減小;②反應i為氣體分子總數增大的反應,增大壓強,CO的體積分數減小,反應ii為氣體分子總數相等的反應,壓強不影響平衡,增大壓強,CO的體積分數不變,綜上所述,增大壓強,CO的體積分數減小,故P1>P2>P3;③設反應i中參加反應的CH3OH(g)的物質的量為x,則生成的CO的物質的量為x,應用差量法,反應i中氣體總物質的量增大2x,反應ii中氣體總物質的量不變,故平衡時容器內氣體總物質的量為(2+2x)mol;體系中CO2的物質的量為0.2mol,則消耗CO的物質的量為,則平衡時CO的物質的量為(x-0.2)mol,結合圖2得![]() ,解得,則反應ii的平衡常數
,解得,則反應ii的平衡常數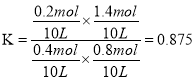 。
。


科目:高中化學 來源: 題型:
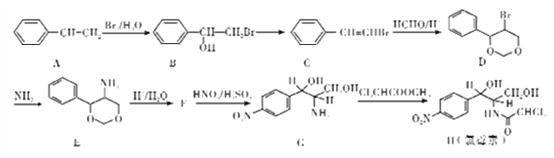
【題目】氯毒素是廣譜抗菌素,主要用于治療傷寒桿菌、痢疾桿菌、腦膜炎球菌、肺炎球菌的的感染。其中一種合成路線如下:
已知: 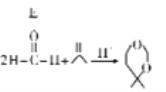
(1)A![]() B,G
B,G![]() H反應類型分別是:____、____。
H反應類型分別是:____、____。
(2)寫出B![]() C的化學方程式(注明反應條件)________
C的化學方程式(注明反應條件)________
(3)寫出F的結構簡式_______
(4)寫出H(氯霉素)分子中所們含氧官能團的名稱____。1mol氯霉素最多消耗_____molNaOH。
(5)符合下列條件的E的同分異構體共有____________種。
①苯環上含有兩個對位取代基,一個是氨基
②能水解
③能發生銀鏡反應
寫出其中一種的結構簡式___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列應用與鹽類水解無關的是
A. 純堿溶液可去除油污
B. 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫滅火劑
C. TiCl4溶于大量水加熱制備TiO2
D. 一定濃度NaHSO4溶液中加入甲基橙溶液呈紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一容積固定的密閉反應器,中間有一個可自由移動的導熱的隔板將容器分成甲、乙兩部分,分別發生下列兩個可逆反應:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均達到反應平衡后隔板位于正中間,然后進行相關操作后,下列敘述錯誤的是
A. 在反應器恒溫下,向乙中通入z氣體,c的物質的量濃度增大
B. 在反應器恒溫下,向甲中通入惰性氣體,乙中x、y的轉化率增大
C. 在反應器絕熱下,向乙中通入z氣體,反應器中溫度升高
D. 在反應器絕熱下,向甲中通入惰性氣體,c的物質的量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣的制取與儲存是氫能源利用領域的研究熱點。回答下列問題:
(1)直接熱分解法制氫
某溫度下,2H2O(g)![]() 2H2(g)+O2(g),該反應的平衡常數表達式為K=______。
2H2(g)+O2(g),該反應的平衡常數表達式為K=______。
(2)乙醇水蒸氣重整制氫
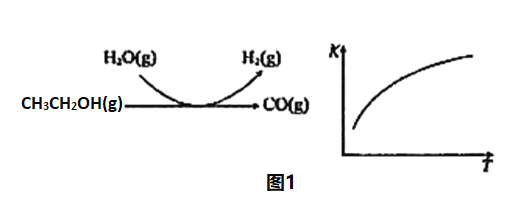
反應過程和反應的平衡常數(K)隨溫度(T)的變化曲線如圖1所示。某溫度下,圖1所示反應每生成1molH2(g),熱量變化是62kJ,則該反應的熱化學方程式為_____________。
(3)水煤氣法制氫
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在進氣比[n(CO):n(H2O)]不同時,測得相應的CO的平衡轉化率見圖2(圖中各點對應的反應溫度可能相同,也可能不同)。
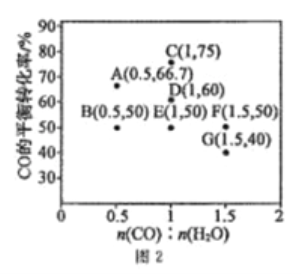
①向2L恒溫恒容密閉容器中加入一定量的CO和0.1molH2O(g),在圖中G點對應溫度下,反應經5min達到平衡,則平均反應速率v(CO)=________。
②圖中B、E兩點對應的反應溫度分別為TB和TE,則TB_____TE(填“>”“<”或“=”)。
③經分析,A、E、G三點對應的反應溫度都相同(均為T℃),其原因是A、E、G三點對應的_________相同。
④當T℃時,若向一容積可變的密閉容器中同時充入3.0molCO、1.0molH2O(g)、1.0molCO2和x molH2,為使上述反應開始時向正反應方向進行,則x應滿足的條件是______。
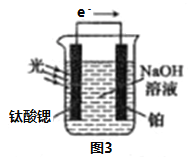
(4)光電化學分解制氫
反應原理如圖3,鈦酸鍶光電極的電極反應式為4OH--4e-=O2↑+2H2O,則鉑電極的電極反應式為________________。
(5)Mg2Cu是一種儲氫合金。350℃時,Mg2Cu與H2反應,生成MgCu2和僅含一種金屬元素的氫化物(其中氫的質量分數約為7.7%)。該反應的化學方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中反應物總能量小于生成物總能量的是( )
A.鈉和水的反應
B.炭與水蒸氣制水煤氣的反應
C.鹽酸與氫氧化鈉溶液的反應
D.鋁在氧氣中燃燒的反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在復習元素化合物的性質時,做了如下學習筆記,請你一起完成。
(1)氯氣的顏色為__________;由氯的原子結構示意圖推測,氯氣具有很強的______ 性。為了證明推測是否正確,進行如下實驗:
I:將紅熱的鐵絲伸入盛滿氯氣的集氣瓶,觀察鐵絲在氯氣中燃燒,有大量棕黃色煙。該反應的化學方程式是___________。
II:在空氣中點燃H2,然后將導管緩緩伸入盛滿氯氣的集氣瓶,可觀察到H2在氯氣中安靜燃燒,產生______色的火焰,瓶口有白霧的現象。
由實驗I、II可知,上述推測_____(填“正確”或“不正確”);理由是_____。
III:將氯氣溶于水,制得氯水。下列物質不能與新制氯水反應的是_____。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)下列是一些常見物質之間的轉化關系。A是一種紅色金屬,F為不溶于酸的白色沉淀,B和C是兩種強酸。(圖中部分產物及反應條件略去)
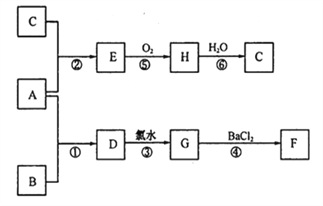
則:①A和B 分別為:A_________ B_________;
②A與B發生反應的條件是__________________;
③反應⑥的化學方程式為_____________________;
④上述反應中,不屬于氧化還原反應的是_______________。(填數字序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著科技的進步,合理利用資源、保護環境成為當今社會關注的焦點。甲胺鉛碘(CH3NH3PbI3)可用于全固態鈣鈦礦敏化太陽能電池的敏化劑,由CH3NH2、PbI2及HI為原料合成,回答下列問題:
(1)制取甲胺的反應為CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知該反應中相關化學鍵的鍵能數據如下:
CH3NH2(g)+H2O(g)△H。已知該反應中相關化學鍵的鍵能數據如下:
共價鍵 | C-O | H-O | N-H | C-N |
鍵能/kJmol-1 | 351 | 463 | 393 | 293 |
則該反應的△H=________kJmol-1
(2)上述反應中所需甲醇工業上利用水煤氣合成,反應為CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定條件下,將lmolCO和2molH2通入密閉容器中進行反應,當改變某一外界條件(溫度或壓強)時,CH3OH的體積分數φ(CH3OH)變化趨勢如圖所示:
CH3OH(g)△H<0。在一定條件下,將lmolCO和2molH2通入密閉容器中進行反應,當改變某一外界條件(溫度或壓強)時,CH3OH的體積分數φ(CH3OH)變化趨勢如圖所示:
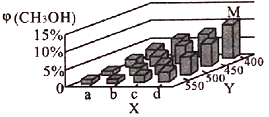
①平衡時,M點CH3OH的體積分數為10%,則CO的轉化率為____________________。
②X軸上a點的數值比b點_______(填“大”或“小”)。某同學認為上圖中Y軸表示溫度,你認為他判斷的理由是______________________________________。
(3)常溫下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,則反應PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常數K=_______________。
PbI2(s)+2Cl-(aq)的平衡常數K=_______________。
(4)分解HI曲線和液相法制備HI反應曲線分別如圖1和圖2所示:
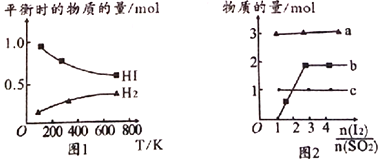
①反應H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②將二氧化硫通入碘水中會發生反應:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,圖2中曲線a、b分別代表的微粒是_______、__________(填微粒符號);由圖2知要提高碘的還原率,除控溫度外,還可以采取的措施是減小___________________________________。
I3-,圖2中曲線a、b分別代表的微粒是_______、__________(填微粒符號);由圖2知要提高碘的還原率,除控溫度外,還可以采取的措施是減小___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是
A. FeSO4酸性溶液中加H2O2溶液:Fe2++H2O2+2H+==Fe3++2H2O
B. 明礬溶液中加過量氫氧化鋇溶液:Ba2++SO![]() == BaSO4↓
== BaSO4↓
C. 亞硫酸氫鈉溶液中加氫氧化鈉溶液:HSO![]() +OH-== SO
+OH-== SO![]() +H2O
+H2O
D. 稀硝酸加入碳酸銀中有氣泡產生:CO![]() +2H+==CO2↑+H2O
+2H+==CO2↑+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com