
【題目】(1)A、B、C三種可溶性化合物,它們的陽離子可能是Na+、Mg2+、Ag+,陰離子可能是NO3-、OH-、Cl-,分別取相同質量的三種化合物,溶解于水,配制相同體積的溶液, 其物質的量的濃度由大到小的順序是A、B、C,則三種化合物化學式分別是:A______、B______、C_________________。
(2)有以下3種物質:①Na2CO3固體②Fe(OH)3膠體③硫化銻(Sb2S3)膠體
填空回答:
A.①既是鈉鹽又是碳酸鹽,對該物質的分類方法是___________________________。
B.實驗室制備②的化學方程式為_____________________________________。
C.橘紅色的硫化銻(Sb2S3)膠體,裝入U型管,插入電極后通直流電,發現陽極附近橘紅色加深,證明Sb2S3膠粒帶_____電荷。
【答案】 NaOH MgCl2 AgNO3 交叉分類法 FeCl3+ 3H2O![]() Fe(OH)3(膠體)+3HCl 負
Fe(OH)3(膠體)+3HCl 負
【解析】試題分析:(1)A、B、C三種可溶性化合物,它們的陽離子可能是Na+、Mg2+、Ag+,陰離子可能是NO3-、OH-、Cl-,氫氧化物只能是氫氧化鈉可溶,氯化鎂可溶、硝酸銀可溶。分別取相同質量的三種化合物,溶解于水,配制相同體積的溶液, 其物質的量的濃度由大到小的順序是A、B、C,則三種化合物的摩爾質量從小到大的順序為A、B、C,所以其化學式分別是NaOH、MgCl2、AgNO3。
(2)A.①Na2CO3既是鈉鹽又是碳酸鹽,對該物質的分類方法是交叉分類法。
B.實驗室制備②Fe(OH)3膠體的化學方程式為FeCl3+ 3H2O![]() Fe(OH)3(膠體)+3HCl。
Fe(OH)3(膠體)+3HCl。
C.橘紅色的硫化銻(Sb2S3)膠體,裝入U型管,插入電極后通直流電,發現陽極附近橘紅色加深,證明Sb2S3膠粒帶負電荷。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:
【題目】以富含硫酸亞鐵的工業廢液為原料生產氧化鐵的工藝如下(部分操作和條件略):
I.從廢液中提純并結晶出FeSO4·7H2O;
Ⅱ.將FeSO4·7H2O配制成溶液
Ⅲ.將FeSO4溶液與稍過量的NH4HCO3溶液混合,得到含FeCO3的濁液
Ⅳ.將濁液過濾,用90℃熱水洗滌沉淀,干燥后得到FeCO3固體;
V.煅燒FeCO3,得到Fe2O3固體
已知:NH4HCO3在熱水中分解
(1)I中,加足量的鐵屑除去廢液中的Fe3+,該反應的離子方程式是____。
(2)Ⅱ中,需加一定量硫酸,運用化學平衡原理簡述硫酸的作用______________。
(3)Ⅲ中,生成FeCO3的離子方程式是________。若FeCO3濁液長時間暴露在空氣中,會有部分固體表面變為紅褐色,該變化的化學方程式是_____________。
(4)Ⅳ中,通過檢驗SO42-來判斷沉淀是否洗滌干凈。檢驗SO42-的操作是 __________。
(5)已知煅燒FeCO3的化學方程式是:____________。現煅燒464.0 kg FeCO3,得到316.8 kg產品。若產品中雜質只有Fe2O3,則該產品中Fe2O3的質量是____kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業生產硝酸銨的流程如下圖所示:
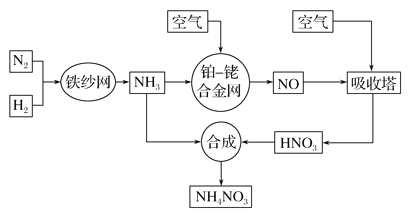
請回答下列問題:
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和鐵催化條件下向一密閉容器中充入1 mol N2和3 mol H2,充分反應后,放出的熱量________(填“大于”、“小于”或“等于”)92.4 kJ。
②為提高H2的轉化率,實際生產中宜采取的措施有________(填字母)。
A.降低溫度
B.最適合催化劑活性的適當高溫
C.適當增大壓強
D.減小壓強
E.循環利用和不斷補充氮氣
F.及時移出氨
(2)該流程中鉑—銠合金網上的氧化還原反應為4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知鉑—銠合金網未預熱也會發熱,則隨著溫度升高,該反應的化學平衡常數K________(填“增大”、“減小”或“不變”),理由是__________________________________________________________________。
②若其他條件不變,則下列圖像正確的是________(填字母)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各原子或離子的電子排布式錯誤的是( )
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p4 C. Na+ 1s22s22p6 D. F 1s22s22p5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物A(分子式為C6H6O)是一種有機化工原料,在空氣中易被氧化。A 的有關轉化反應如下(部分反應條件略去):

已知:①
② (R表示烴基,R′和R″表示烴基或氫)
(R表示烴基,R′和R″表示烴基或氫)
③F和D互為同分異構體
(1)寫出A的名稱:________________。
(2)G是常用指示劑酚酞,G中能夠與NaOH溶液反應的官能團的名稱:_______________。
(3)A能夠與甲醛形成一種線型結構高分子,其結構簡式為:__________。
(4)分別寫出反應A→B和E→F的化學方程式,并注明反應類型:
A→B:________________________________________________,
E→F:________________________________________________,
(5)符合下列條件的C的同分異構體共_______種。
①能發生銀鏡反應②分子中不含環狀結構
寫出其中含有三個甲基的分子的結構簡式_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1) 3.01×1023個CO2分子中含_____________mol氧原子,在標準狀況下其體積為____L,0.4 molOH-的中有 ______個電子。
(2)實驗中需取0.1mol CuSO4配制溶液,若用CuSO4 5H2O替代,則應稱取CuSO4 5H2O的質最為___g。
(3)同溫同壓下,等質量的N2和CO2所含分子數比為_____,體積比為________。
(4)某氣體在標準狀況下的密度為1.25g/L,則28g該氣體所含有的分子數為_____________。
(5)在標準狀況下22.4L由氮氣和氧氣組成的混合氣體,其質量為30g,則其中氧氣的質量為____g。
(6)用98%的濃硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制過程中需量取濃硫酸____mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖1表示可以判斷:若T1>T2,反應A(g)+B(g)![]() 2C(g)ΔH<0
2C(g)ΔH<0
B. 圖2表示0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得到的滴定曲線
C. 圖3表示壓強對可逆反應2A(g)+2B(g)![]() 3C(g)+D(s)的影響,甲比乙的壓強大
3C(g)+D(s)的影響,甲比乙的壓強大
D. 如圖4,若除去CuSO4溶液中的Fe3+可向溶液中加入適量CuO至pH在6.5左右
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】迷迭香酸是從蜂花屬植物中提取得到的酸性物質,其結構如右圖。下列敘述正確的是( )

A. 迷迭香酸屬于芳香烴
B. 1mol迷迭香酸最多能和9mol氫氣發生加成反應
C. 迷迭香酸可以發生水解反應、取代反應和酯化反應
D. 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組的同學設計了如圖裝置制取溴苯和溴乙烷:

已知:乙醇在加熱的條件下可與HBr反應得到溴乙烷(CH3CH2Br),二者某些物理性質如下表所示:
溶解性(本身均可作溶劑) | 沸點(℃) | 密度(g/mL) | |
乙醇 | 與水互溶,易溶于有機溶劑 | 78.5 | 0.8 |
溴乙烷 | 難溶于水,易溶于有機溶劑 | 38.4 | 1.4 |
請回答下列問題:
(1)B中發生反應生成目標產物的化學方程式為___________。
(2)根據實驗目的,選擇合適的實驗步驟:①→____________。
①組裝好裝置,_________________(填寫實驗操作名稱);
②將A裝置中的純鐵絲小心向下插入苯和液溴的混合液中;
③點燃B裝置中的酒精燈,用小火緩緩對錐形瓶加熱10分鐘;
④向燒瓶中加入一定量苯和液溴,向錐形瓶中加入無水乙醇至稍高于進氣導管口處,向U形管中加入蒸餾水封住管底,向水槽中加人冰水。
(3)簡述實驗中用純鐵絲代替鐵粉的優點:_________________。
(4)反應完畢后,U形管內的現象是_________;分離溴乙烷時所需的玻璃儀器是___________。
(5)假設最初取用的無水乙醇是71.9 mL,最后得到的純凈的溴乙烷是66.2 mL,則溴乙烷的產率為______________(保留兩位小數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com