
【題目】【加試題】甲醇水蒸氣重整制氫(SRM)是用于驅動電動汽車的質子交換膜燃料電池的理想氫源,當 前研究主要集中在提高催化劑活性和降低尾氣中CO含量,以免使燃料電池Pt電極中毒。重整過程發生的反應如下:
反應I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反應Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反應Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其對應的平衡常數分別為K1、K2、K3,其中K2、K3隨溫度變化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
請回答:
(1)反應Ⅱ能夠自發進行的條件_______ (填 “低溫”、“高溫”或“任何溫度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同條件下,甲醇水蒸氣重整制氫較甲醇直接分解制氫(反應Ⅱ)的先進之處在于_________。
(3)在常壓、CaO催化下,CH3OH和H2O混和氣體(體積比1∶1.2,總物質的量2.2mol)進行反應,tl時刻測得 CH3OH轉化率及CO、CO2選擇性隨溫度變化情況分別如圖所示(CO、CO2的選擇性:轉化的CH3OH中生成CO、CO2的百分比)。
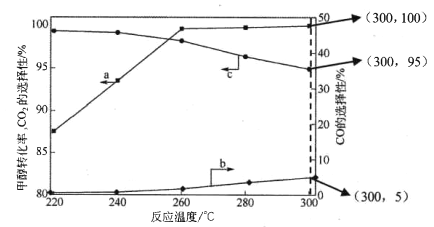
注:曲線a表示CH3OH的轉化率,曲線b表示CO的選擇性,曲線c表示 CO2的選擇性
① 下列說法不正確的是_____。
A.反應適宜溫度為300℃
B.工業生產通 常在負壓條件下進行甲醇水蒸氣重整
C.己知 CaO催化劑具有更高催化活性,可提高甲醇平衡轉化率
D.添加CaO的復合催化劑可提高氫氣產率
② 260℃ 時H2物質的量隨時間的變化曲線如圖所示。畫出300℃時至t1時刻H2物質的量隨時間的變化曲線_____。
(4)副產物CO2可以在酸性水溶液中電解生成甲酸,生成甲酸的電極反應式是_________。
【答案】 高溫 > 甲醇轉化率高;產物中氫氣含量高,一氧化碳含量低 ABC 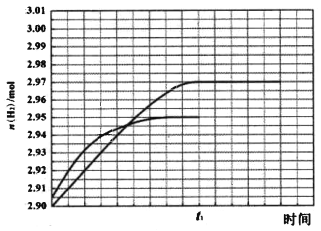 CO2+2H++2e-=HCOOH
CO2+2H++2e-=HCOOH
【解析】(1)由表中數據可得,隨溫度升高,K2增大,即反應Ⅱ向右移動,說明反應Ⅱ是吸熱反應,ΔH2>0,由反應方程式可得ΔS2>0,已知反應能夠自發進行的條件是ΔH2-TΔS2<0,推知反應Ⅱ需要在高溫下才能自發進行;由于K3隨溫度升高而減小,即反應Ⅲ向左移動,說明反應Ⅲ是放熱反應,ΔH3<0,根據蓋斯定律,ΔH1=ΔH2+ΔH3>ΔH3,
(2)由反應I和反應Ⅱ的方程式比較可知,反應物甲醇轉化率高,產物中氫氣含量高,且幾乎沒有CO;
(3)①A、由圖象可知CH3OH的轉化率在高于260℃時較高,但在300℃時,CO的選擇性最高,而CO2的選擇性最低,所以300℃不是反應適宜的溫度,最好在260℃時,故A不正確;B、根據反應方程式可知,減小壓強會降低反應速率,不適合工業生產,所以B不正確;C、催化劑能夠加快反應速率,但不能改變反應物的轉化率,所以C不正確;D、催化劑能加快反應速率,提高單位時間內生成氫氣的量,即提高了氫氣的產率,即D正確;因此本題正確答案選ABC;②根據甲醇的轉化率、CO和CO2選擇性圖象可知,溫度從260℃升高到300℃,反應速率加快,但CO2的選擇性減小,使H2的物質的量也減小,所以曲線斜率增大,但水平線低于260℃時的,具體為:反應I 中生成n(H2)= 3n(CO2)=0.95×1mol×3= 2.85mol,反應Ⅱ中生成n(H2)=2n(CO)=0.05×1mol×2=0.10mol,所以生成H2的總物質的量為2.95mol,則畫出圖象如圖所示,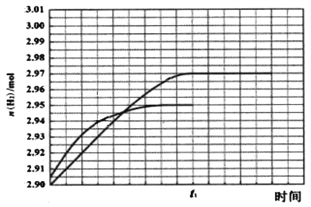 ;
;
(4)CO2在酸性溶液中生成甲酸(HCOOH)時,C元素的化合價是降低,得到電子,將在負極發生反應,反應式為CO2+2H++2e-=HCOOH,


 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:
【題目】(1)下列物質是電解質的有___________,是非電解質的有_______,在本題指定狀態下能導電的有_________。(以上各空均填序號)
①CO2、②液態HCl、③稀硝酸、④Al2(SO4)3晶體、⑤NH3、⑥熔融KOH、⑦單質鐵。
(2)在標準狀況下,測得1.32 g某氣體的體積為0.672 L。則此氣體的摩爾質量為____________。等質量CO、CO2兩種氣體的的摩爾質量之比為_______________;同溫同壓下的體積比為______________。
(3)用于分離或提純物質的常見方法有:A蒸餾(分餾) B萃取 C過濾 D分液。
下列各組混合物的分離或提純應選用上述哪一種方法最合適?(填方法的標號)
①除去Ca(OH)2溶液中懸浮的CaCO3微粒_______。
②分離四氯化碳與水的混合物_______。
③分離汽油和煤油_______。
④提取碘水中的碘單質_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下用0.1000mol/L的鹽酸分別逐滴加入到20.00mL0.1000 mo1/L的三種一元堿MOH、XOH、YOH溶液中,溶液的pH隨加入鹽酸體積的變化如圖所示。 下列說法不正確的是
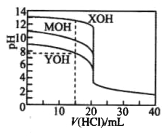
A. XOH為強堿,MOH、YOH均 為弱堿
B. V(HCl)=15.00mL時,三份溶液中離子總濃度大小順序: XOH>MOH>YOH
C. 當鹽酸滴加至20.00 mL時,三條曲線剛好相交
D. 在逐滴加入鹽酸至40.00mL的過程中,三份溶液中水的電離程度均先增大后減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中的c(Cl﹣)與50mL1molL﹣1 氯化鋁溶液中的c(Cl﹣)相等的是( )
A.150mL1molL﹣1氯化鈉溶液
B.75mL2molL﹣1氯化銨溶液
C.150mL3molL﹣1氯化鉀溶液
D.75mL2molL﹣1氯化鋇溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,體積和pH都相同的鹽酸和氯化銨溶液加水稀釋時的pH變化曲線如圖所示。下列判斷正確的是

A. a、c兩點溶液的導電能力相同
B. a、b、c三點溶液中水的電離程度:a>b>c
C. b點溶液中:c(H+)+c(NH3·H2O)=c(OH—)
D. 用等濃度NaOH溶液和等體積b、c處溶液反應,消耗NaOH溶液體積Vb=Vc
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去KCl固體中少量的MgCl2、MgSO4,可選用Ba(OH)2、鹽酸和K2CO3三種 試劑,按如下步驟操作:
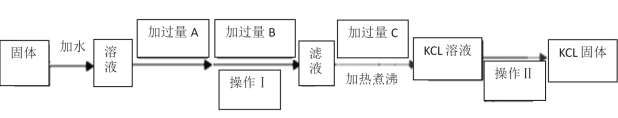
(1)圖中三種試劑分別為:A__________________、 B__________________、 C___________________。
(2)加入過量A的目的是______________________________________________________________________;
加入過量B的目的是______________________________________________________________________;
加熱煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名稱是______________________________。
(4)檢驗得到的KCl中不含有SO42-的操作________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 按系統命名法![]() 的名稱為2—甲基—3,5—二乙基己烷
的名稱為2—甲基—3,5—二乙基己烷
B. 分子![]() 結構中,最多有7個碳原子共線
結構中,最多有7個碳原子共線
C. 分子式為C4H10O能與金屬鈉反應并能發生催化氧化的有機物有4種(不含立體異構)
D. 全降解塑料(![]() )可由單體環氧丙烷(
)可由單體環氧丙烷(![]() )和CO2加聚制得
)和CO2加聚制得
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性甲醛燃料電池為電源進行電解的實驗裝置如圖所示,下列說法中正確的是

A. 當a、b都是銅作電極時,電解的總反應方程式為2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B. 燃料電池工作時,正極反應為O2+2H2O+4e-===4OH-
C. 當燃料電池消耗22.4 L甲醛氣體時,電路中理論上轉移2 mol e-
D. 燃料電池工作時,負極反應為HCHO+H2O-2e-===HCOOH+2H+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com