
【題目】已知SO2+I2+2H2O===H2SO4+2HI,某化學興趣小組選用下列實驗裝置,測定工業原料氣(含SO2、N2、O2)中SO2的含量。

(1)若原料氣從左流向右時,上述裝置組裝連接的順序:原料氣→__________________(填“a”“b”“c”“d”“e”)。
(2)裝置Ⅱ中發生反應的離子方程式為_____________;當裝置Ⅱ中出現________現象時,立即停止通氣。
(3)若碘溶液的濃度為0.05 mol/L、體積為20 mL,收集到的N2與O2的體積為297.6 mL(已折算為標準狀況下的體積),SO2的體積分數為________。
【答案】c→d→b→a→eSO2+I2+2H2O===4H++SO42-+2I-藍色褪去7%
【解析】
(1)本題考查了排水法的連接順序;SO2用碘吸收,氧氣和氮氣不溶于水,可用通過排水法測量起體積。
(2)根據方程式可直接寫出離子方程式。
(3)找出SO2與I2對應關系,求出SO2體積,可以求出混合氣體中SO2的體積分數。
:(1)SO2用碘吸收,氧氣和氮氣不溶于水,可用通過排水法測量起體積;所以正確的順序為原料氣→c→d→b→a→e;正確答案:c→d→b→a→e。
(2)二氧化硫、碘與水混合反應生成硫酸和氫碘酸,反應的離子方程式為:SO2+I2+2H2O=4H++SO42-+2I-;由于碘遇淀粉顯藍色,所以當溶液藍色褪去時,即停止通氣;正確答案:SO2+I2+2H2O===4H++SO42-+2I-; 藍色褪去。
(3)由反應方程式可知: SO2---I2關系可知:V(SO2)=0.05×20×10-3×22.4×1000=22.4mL,則SO2的體積分數為=22.4/(297.6+22.4)×100%=7%;正確答案:7%。


科目:高中化學 來源: 題型:
【題目】接觸法制硫酸工藝中,主反應在450℃并有催化劑存在下進行:![]()
![]()
(1)恒溫恒容條件下,下列能說明此反應已達平衡的是________。
①![]()
②容器中氣體的平均摩爾質量不隨時間而變化
③容器中氣體的密度不隨時間而變化
④容器中氣體分子總數不隨時間而變化
(2)下列有關該反應速率的敘述中,正確的是_________。
a. 升高溫度可以增大活化分子百分數,加快反應速率
b. 使用催化劑提高二氧化硫的轉化率
c. 使用催化劑可以使反應物分子平均能量升高,加快反應速率
d. 縮小容器體積增大壓強不能增大活化分子百分數,但可以加快反應速率
(3)下圖表示將![]() 和
和![]() 置于2L密閉容器中,當其他條件一定時,
置于2L密閉容器中,當其他條件一定時, ![]() 的平衡轉化率a隨X的變化關系,
的平衡轉化率a隨X的變化關系, ![]() 代表壓強或溫度。X代表的物理量是___________。A對應條件下平衡常數K=___________。
代表壓強或溫度。X代表的物理量是___________。A對應條件下平衡常數K=___________。

(4)一定溫度下,在容積不變的密閉容器中充入![]() 和
和![]() ,達平衡時
,達平衡時![]() 的體積分數為a%,其他條件不變時,若按下列四種配比作為起始物質,平衡后
的體積分數為a%,其他條件不變時,若按下列四種配比作為起始物質,平衡后![]() 的體積分數仍為a%的是__________。
的體積分數仍為a%的是__________。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(5)![]() 與
與![]() 反應生成
反應生成![]() ,
, ![]() 電離方程式為___________,向
電離方程式為___________,向![]() 溶液中加入
溶液中加入![]() 固體,則電離平衡往__________反應方向移動。
固體,則電離平衡往__________反應方向移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】咖啡酸具有止血功效,存在于多種中藥中,其結構簡式如下圖,下列說法不正確的是
![]()
A. 咖啡酸可以發生取代、加成、氧化、酯化、加聚反應
B. 1mol 咖啡酸最多能與5 mol H2反應
C. 咖啡酸分子中所有原子可能共面
D. 蜂膠的分子式為C17H16O4,在一定條件下可水解生成咖啡酸和一種一元醇A,則醇A 的分子式為C8H10O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,固定容積的密閉容器中,CO和H2反應生成甲醇:CO(g)+2H2(g)![]() CH3OH(g).如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線.下列判斷正確的是
CH3OH(g).如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線.下列判斷正確的是
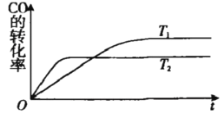
A.T1>T2,該反應的△H>0
B.加入催化劑可以提高CO的轉化率
C.T1時的平衡常數時的平衡常數K1>T2時的平衡常數K2
D.溫度降低,CO(g)+2H2(g)![]() CH3OH(I)的△H值將變大
CH3OH(I)的△H值將變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鉻鋼俗稱不銹鋼,在日常生活中應用廣泛,含有鐵、鉻、鎳、碳等元素。
請回答下列問題:
(1)鎳的基態原子核外價層電子排布式為_______________,基態Fe3+有_____種不同運動狀態的電子,基態鉻原子有__________個未成對電子。
(2)配合物[Cr(H2O)6]3+中,與Cr3+形成配位鍵的原子是_______________(填元素符號),鉻的高價化合物可將CH3CH2OH 氧化為CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的雜化方式分別為_______________、___________________。
(3)鎳能與CO 形成Ni(CO)4,常溫下Ni(CO)4是無色液體,易溶于有機溶劑,推測Ni(CO)4是__________晶體,組成Ni(CO)4的三種元素電負性由大到小的順序為_______________(填元素符號),CO 分子中π鍵與σ鍵的個數比為_______________。
(4)NiO 的立方晶體結構如圖所示,則O2-填入Ni2+構成的________空隙(填“正四面體”、“正八面體”、“ 立方體”或“壓扁八面體”)。NiO晶體的密度為ρg·cm-3,Ni2+和O2-的半徑分別為r1pm和r2pm,阿伏加德羅常數值為NA,則該晶胞中原子的體積占晶胞體積的百分率為___________________________________。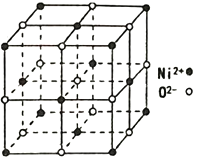
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖硬質玻璃管A中放入干燥的細銅絲,左方燒杯中盛有溫水,試管B中盛有甲醇,試管C中盛有冷水。向B中不斷鼓入空氣,使甲醇蒸氣和空氣通過加熱到紅熱程度的銅絲。
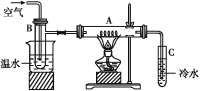
(1)撤去A處酒精燈后銅絲仍然能保持紅熱的原因是___________________
(2)反應后將試管C中的液體冷卻,取出少量,倒入新制的Cu(OH)2,加熱到沸騰可觀察到的現象是___________________
查看答案和解析>>
科目:高中化學 來源: 題型:
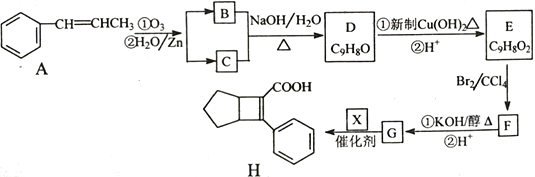
【題目】化合物H是一種有機材料中間體。實驗室由芳香化合物A制備H的一種合成路線如下;
已知:①![]()
②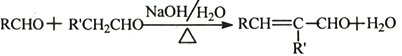
③![]()
請回答下列問題:
(1)芳香族化合物B的名稱為__________,C的同系物中相對分子質量最小的結構簡式為__________。
(2)由F生成G的第①步反應類型為_______________。
(3)X的結構簡式為_______________。
(4)寫出D生成E的第①步反應化學方程式____________________________。
(5)G與乙醇發生酯化反應生成化合物Y,Y有多種同分異構體,其中符合下列條件的同分異構體有__________種,寫出其中任意一種的結構簡式_____________________。
①分子中含有苯環,且能與飽和碳酸氫鈉溶液反應放出CO2
②其核磁共振氫譜顯示有4種不同化學環境的氫,峰面積比為6∶2∶1∶1。
(6)寫出用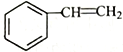 為原料制備化合物
為原料制備化合物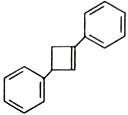 的合成路線,其它無機試劑任選_____________________________________________。
的合成路線,其它無機試劑任選_____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示,A為銀白色金屬,A、B、C、D、E、F中均含有同一種元素。常溫下G為液態,H為氣態。

試回答:
(1)寫出化學式:C________,D________,F________,H________。
(2)A與水反應的化學方程式為___________________________________________________。
(3)寫出F→E的化學方程式:___________________________________________________。
(4)若向E的飽和溶液中通入足量的H,實驗現象為_________________________________。
(5)寫出F的一種用途___________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com