
亞硝酸鈉是一種防腐劑和增色劑,但在食品中過量時會對人體產生危害。其在酸性條件下會產生NO和NO2。下列有關說法錯誤的是( )
| A.NaNO2既具有氧化性又具有還原性 |
| B.食用“醋溜豆芽”可能會減少亞硝酸鈉對人體的危害 |
C.NaNO2和胃酸作用的離子方程式為: |
| D.1 mol NaNO2在酸性條件下完全反應生成NO和NO2,轉移電子的物質的量為1 mol |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:單選題
1.76克銅鎂合金完全溶解于50mL、密度為1.40g/cm3、質量分數為63%的濃硝酸中,得到NO2氣體1792mL (標準狀況),向反應后的溶液中加入適量的1.0mol/LNaOH溶液,恰使溶液中的金屬離子全部沉淀。下列說法不正確的是( )
| A.該濃硝酸中HNO3的物質的量濃度是14.0mol/L |
| B.加入NaOH溶液的體積是50mL |
| C.濃硝酸在與合金反應中起了酸性和氧化性的雙重作用,且起氧化性的硝酸的物質的量為0.08mol |
| D.得到的金屬氫氧化物的沉淀為3.12克 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
新型陶瓷材料氮化硅(Si3 N4)可以通過以下反應制得:3SiO2+6C+2N2 Si3N4+6CO,下列就該反應的分析錯誤的是
Si3N4+6CO,下列就該反應的分析錯誤的是
| A.壓強增大,平衡向逆反應方向移動 |
| B.SiO2是氧化劑,CO是氧化產物 |
| C.上述反應若為放熱反應,升高溫度,平衡常數將減小 |
| D.上述反應中每生成1 molSi3N4,氮元素得12mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述正確的是( )。
| A.陽離子只有氧化性,陰離子只有還原性 |
| B.含氧酸可作氧化劑而無氧酸不能 |
| C.在8NH3+3Cl2=N2+6NH4Cl反應中氧化劑與還原劑物質的量之比是2∶3 |
| D.已知還原性:Fe2+>Br-,可知反應2Fe3++2Br-=2Fe2++Br2不易進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據表中信息,判斷下列敘述中正確的是 ( )。
| 序號 | 氧化劑 | 還原劑 | 其他反應物 | 氧化產物 | 還原產物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 濃鹽酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
氧化還原反應中,水的作用可以是氧化劑、還原劑、既是氧化劑又是還原劑、既非氧化劑又非還原劑等。下列反應與Br2+SO2+2H2O=H2SO4+2HBr相比較,水的作用不相同的是( )
①2Na2O2+2H2O=4NaOH+O2↑
②4Fe(OH)2+O2+2H2O=4Fe(OH)3
③2F2+2H2O=4HF+O2
④2Al+2NaOH+2H2O=2NaAlO2+3H2↑
| A.①② | B.②③ | C.①③ | D.③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有Fe2+、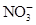 、Fe3+、
、Fe3+、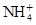 、H2O和H+六種粒子,分別屬于同一氧化還原反應中的反應物和生成物,下列敘述錯誤的是( )
、H2O和H+六種粒子,分別屬于同一氧化還原反應中的反應物和生成物,下列敘述錯誤的是( )
| A.氧化劑與還原劑的物質的量之比為8∶1 |
B.還原產物為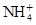 |
C.若有1 mol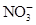 參加還原反應,轉移8 mol e- 參加還原反應,轉移8 mol e- |
| D.若把該反應設計為原電池,則負極反應為Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知離子方程式:As2S3+H2O+NO3—―→AsO43—+SO42—+NO↑+______K(未配平),下列說法錯誤的是( )。
| A.配平后水的化學計量數為4 |
| B.反應后溶液呈酸性 |
| C.配平后氧化劑與還原劑的物質的量之比為3∶28 |
| D.氧化產物為AsO43—和SO42— |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com