
【題目】把NaHCO3和Na2CO3·10H2O混和物6.56g溶于水制成100mL溶液,測得溶液中c(Na+)=0.5mol/L。向該溶液中加入一定量鹽酸恰好完全反應,將溶液蒸干后,所得固體質量為
A. 2.93 g B. 5.85 g C. 6.56g D. 無法確定
科目:高中化學 來源: 題型:
【題目】(1)通常狀態下,在100mL的針筒里充有80mL的氯氣,觀察針筒里的現象是______;鐵在氯氣中劇烈燃燒的產物在水溶液中的電離方程式:______________________________________
(2)洪災過后,飲用水的消毒殺菌成為抑制大規模傳染性疾病爆發的有效方法之一,漂白粉是常用的消毒劑
①工業上將氯氣通入石灰乳[Ca(OH)2]制取漂白粉,化學反應方程式為___________________
②漂白粉的主要成分是(填化學式)____________
(3)請寫出一種適合實驗室制備氯氣的反應方程式:__________________________________,該反應中若有1.00mol還原劑被氧化,則有________g氧化劑被還原。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兔耳草醛是食品與化妝品工業中的香料添加劑.工業上可通過有機化工原料A制得,其合成路線如圖所示: 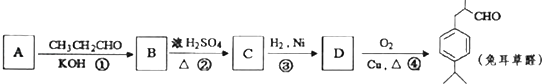
已知:①CH3CHO+CH3CH0 ![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
② ![]() 可寫成
可寫成 ![]()
請回答:
(1)B中含氧官能團的名稱是 .
(2)上述合成路線中反應①屬于,反應②屬于(填寫反應類型).
(3)寫出由D獲得兔耳草醛的化學反應方程式 .
(4)A的同分異構體中符合以下條件的有種.
a.能使FeCl3溶液顯紫色
b.能發生加聚反應
c.苯環上只有兩個互為對位的取代基.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Fe 和 Fe2O3 的混合物共 27.2g,加入 200mL 稀 H2SO4,在標準狀況下收集到 2.24LH2,Fe和 Fe2O3 均無剩余。為中和過量的 H2SO4,并使 Fe 元素全部轉化為 Fe(OH)2 沉淀,消耗了 400mL 3mol/L 的 NaOH 溶液,則該 H2SO4 的物質的量濃度為
A. 3mol/L B. 2.25mol/L C. 2mol/L D. 0.5mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究人員研制出一種可快速充放電的超性能鋁離子電池,Al、Cn為電極,有機陽離子與陰離子(AlCl![]() 、Al2Cl
、Al2Cl![]() )組成的離子液體為電解質。如圖為該電池放電過程示意圖。下列說法錯誤的是( )
)組成的離子液體為電解質。如圖為該電池放電過程示意圖。下列說法錯誤的是( )
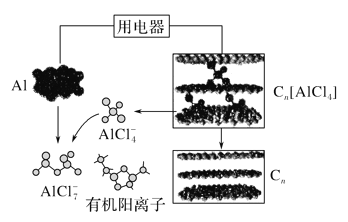
A. 充電時,Al做陰極、Cn為陽極
B. 充電時,每生成1 mol鋁,同時消耗4 mol Al2Cl![]()
C. 放電時,電解質中的有機陽離子向鋁電極方向移動
D. 放電時,正極反應式為Cn[AlCl4]+ e-=== Cn + AlCl![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組為了探究一種抗酸藥X(僅含五種短周期元素)的組成和性質,設計并完成了如下實驗:
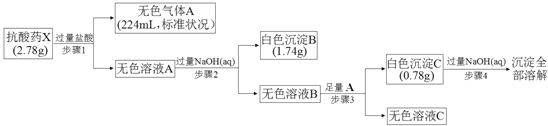
請回答下列問題:
(1)白色沉淀B中金屬元素的離子結構示意圖為_______,A的電子式為__________.
(2)步驟3中生成沉淀C的離子方程式為______________________________.
(3)X的化學式為______________,該抗酸藥不適合胃潰瘍重癥患者使用,原因是______________________________.
(4)設計實驗方案驗證溶液C中的含碳酸氫根離子____________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥用有機物A為一種無色液體,從A出發可發生如下一系列反應.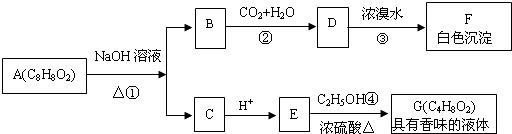
請回答:
(1)E中的官能團名稱是 .
(2)A的結構簡式為 .
(3)寫出反應③的化學方程式: , 該反應的反應類型是 .
(4)寫出反應④的化學方程式: .
(5)符合下列條件的A的同分異構體有(不考慮立體異構)種,寫出其中一種的結構簡式: . ①苯環上有兩個取代基; ②能發生水解反應; ③能發生銀鏡反應.
(6)H是E的一種同分異構體,已知H可以和金屬鈉反應放出氫氣,且在一定條件下可發生銀鏡反應,試寫出H發生銀鏡反應的化學方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以氧化鋁為原料,通過碳熱還原法可合成氮化鋁(AlN);通過電解法可制取鋁.電解鋁時陽極產生的CO2可通過二氧化碳甲烷化再利用.
請回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
碳熱還原Al2O3合成AlN的總熱化學方程式是___________________________。
(2)在常壓、Ru/TiO2催化下,CO2和H2混和氣體(體積比1:4,總物質的量a mol)進行反應,測得CO2轉化率、CH4和CO選擇性隨溫度變化情況分別如圖1和圖2所示(選擇性:轉化的CO2中生成CH4或CO的百分比).
反應ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反應ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
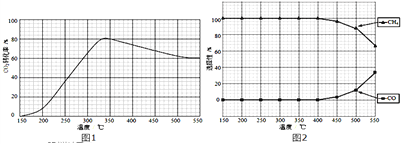
①下列說法不正確的是_______
A.△H4小于零
B.溫度可影響產物的選擇性
C.CO2平衡轉化率隨溫度升高先增大后減少
D.其他條件不變,將CO2和H2的初始體積比改變為1:3,可提高CO2平衡轉化率
②350℃時,反應Ⅰ在t1時刻達到平衡,平衡時容器體積為VL該溫度下反應Ⅰ的平衡常數為______(用a、V表示)
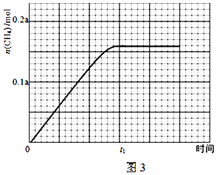
③350℃下CH4物質的量隨時間的變化曲線如圖3所示.畫出400℃下0~t1時刻CH4物質的量隨時間的變化曲線_______.
(3)據文獻報道,CO2可以在堿性水溶液中電解生成甲烷,生成甲烷的電極反應式是_______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用下圖所示的裝置及藥品進行比較酸性強弱的實驗,一段時間后試管②中有膠凍狀物質生成。下列說法正確的是( )
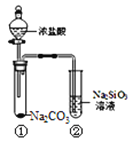
A. 用帶有玻璃塞的試劑瓶盛裝Na2SiO3溶液
B. 試管①中反應的離子方程式是:Na2CO3+ 2H+ = 2Na+ + CO2↑+ H2O
C. 該實驗可以證明酸性:鹽酸>碳酸>硅酸
D. 若將鹽酸換成硫酸,能證明酸性:硫酸>碳酸>硅酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com