
【題目】半水煤氣是工業合成氨的原料氣,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤氣經過下列步驟轉化為合成氨的原料。完成下列填空:
![]()
(1)半水煤氣含有少量硫化氫。將半水煤氣樣品通入 溶液中(填寫試劑名稱),出現 ,可以證明有硫化氫存在。
(2)寫出半水煤氣在銅催化下實現CO變換的反應方程式 ;若半水煤氣中V(H2): V(CO): V(N2)=9:7:4,經CO變換后的氣體中:V(H2): V(N2)=__________。
(3)堿液吸收法是脫除二氧化碳的方法之一。有一吸收了二氧化碳的氫氧化鈉洛液,為測定其溶液組成,采用雙指示劑法進行滴定。
步驟:用移液管量取V0mL的該溶液于錐形瓶中,先滴入1-2滴酚酞做指示劑,滴定達到終點時用去c mol.L-1的標準鹽酸溶液VlmL,此時再向溶液中滴入1-2滴__________做指示劑,達到滴定終點時又用去V2mL標準鹽酸溶液。
第二次滴定達到終點時的現象是______________________。
數據處理:通過Vl和V2的相對大小可以定性也可定量判斷溶液的組成。
若V1>V2,寫出此時的溶質的化學式_______________。
若2V1=V2,寫出此時溶液中離子濃度由大到小的順序_________________。
討論:若V1<V2,在第一次滴定時未用標準鹽酸潤洗酸式滴定管,第二次滴定前發現并糾正了錯誤,則____________(填化學式)濃度偏大。
【答案】
(1)硝酸鉛(或硫酸銅);黑色沉淀;
(2)CO+H2O![]() CO2+H2;4:1
CO2+H2;4:1
(3)甲基橙;當最后一滴標準液滴入,溶液恰好由黃色變橙色,且半分鐘不變色;
Na2CO3和NaOH;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);Na2CO3
【解析】
試題分析:(1)將水煤氣通入硝酸鉛(或硫酸銅)溶液中,出現黑色沉淀,證明含有硫化氫,故答案為:硝酸鉛(或硫酸銅);黑色沉淀;
(2)若半水煤氣中V(H2):V(CO):V(N2)=9:7:4,反應中氮氣體積不變,根據方程式:CO+H2O![]() CO2+H2,可知經CO變換后的氣體中V(H2):V(N2)=(9+7):4=4:1,故答案為:CO+H2O
CO2+H2,可知經CO變換后的氣體中V(H2):V(N2)=(9+7):4=4:1,故答案為:CO+H2O![]() CO2+H2;4:1;
CO2+H2;4:1;
(3)酚酞的變色范圍是8.2~10.0,所以第一次變色后碳酸鈉轉化為碳酸氫鈉,如果繼續滴定,則需要選擇甲基橙作指示劑,終點時的實驗現象是當最后一滴標準液滴入,溶液恰好由黃色變橙色,且半分鐘不變色;若V1>V2,由于碳酸鈉轉化為碳酸氫鈉以及碳酸氫鈉轉化為二氧化碳消耗的鹽酸一樣多,這說明此時的溶質的化學式Na2CO3和NaOH;若2V1=V2,說明溶質是等物質的量的碳酸鈉和碳酸氫鈉,則此時溶液中離子濃度由大到小的順序c (Na+) >c(HCO3-) >c (CO32-) >c(OH-) >c (H+);若Vl<V2,在第一次滴定時未用標準鹽酸潤洗酸式滴定管,則與碳酸鈉反應的鹽酸體積增加,因此如果第二次滴定前發現并糾正了錯誤,則碳酸鈉的濃度偏大,故答案為:甲基橙;當最后一滴標準液滴入,溶液恰好由黃色變橙色,且半分鐘不變色;Na2CO3和NaOH ;c (Na+) >c(HCO3-) >c (CO32-) >c(OH-) >c (H+);Na2CO3。


科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值,下列敘述正確的是( )
A.42g NaHCO3晶體中含有CO32-的數目為0.5NA
B.1 mol OH-和17 g NH3所含的電子數相等
C.1 mol Cl2參加反應轉移電子數一定為2NA
D.2.0g H216O與D216O的混合物中所含中子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用元素周期律知識解釋的是
A. 非金屬性:O > S B. 穩定性:HCl >H Br
C. 酸性:HCl > H2CO3 D. 堿性: LiOH <NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是中學化學中常見物質之間的一些反應關系,其中部分產物未寫出。常溫下X是固體,B和G是液體,其余均為氣體。根據下圖關系推斷:
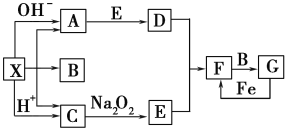
(1)化學式X____________,A__________,B________。
(2)實驗室收集氣體D和F的方法依次是____________法、__________法。
(3)寫出C→E的化學反應方程式_____________________________。
(4)請寫出A與E反應生成D的化學方程式____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.汽油、乙烯均為石油分餾產品
B.金屬鈉在空氣中燃燒的火焰呈黃色,是因為生成的Na2O2為淡黃色固體
C.鐵絲在Cl2中燃燒有紅棕色的煙,是因為生成的FeCl3為紅棕色固體
D.煤的氣化、液化、干餾和石油的裂化、裂解、催化重整不全是化學變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應敘述相符的是
A.圖甲表示壓強對可逆反應2A(g)+2B(g)![]() 3C(g)+D(s)的影響,乙的壓強大
3C(g)+D(s)的影響,乙的壓強大
B.圖乙表示CH3COOH溶液中通入NH3至過量的過程中溶液導電性的變化
C.圖丙表明合成氨反應是放熱反應,b表示在反應體系中加入了催化劑
D.圖丁表示一定濃度Na2CO3溶液中滴加鹽酸,生成CO2與滴加鹽酸物質的量的關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知熱化學方程式:
H2O(g) == H2(g) + O2(g) △H=" +241.8" kJ·mol-1
H2(g)+ O2(g) == H2O(1) △H= -285.8 kJ·mol-1
當1g液態水變為水蒸氣時,其熱量變化是( )
A. 吸熱88kJ B. 吸熱2.44 kJ C. 放熱44kJ D. 吸熱44 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴和碘的化合物在生產和生活中有廣泛的用途.
(1)市場銷售的某種食用精制鹽中含碘酸鉀。
①碘酸鉀與碘化鉀在酸性條件下發生如下反應,配平該反應的化學方程式:
![]()
②上述反應生成的I2可用四氯化碳檢驗,現象為________________________。
向碘的四氯化碳溶液中加入Na2SO3稀溶液,將I2還原,以回收四氯化碳。
Na2SO3稀溶液與I2反應的離子方程式是________________________。
(2)海水提溴過程中溴元素的變化如下:
![]()
①過程I,海水顯堿性,調其pH<3.5后,再通入氯氣,調節海水pH可提高C12的利用率,用平衡原理解釋其原因是_______________________。
②過程II,用熱空氣將溴趕出,再用濃Na2CO3溶液吸收。完成并配平下列方程式。
![]()
③過程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同條件下,若用鹽酸酸化,則所得溴的質量減少,原因是_________________________。
④NaBrO3是一種分析試劑。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,當加入 2.6molNaBrO3時,測得反應后溶液中溴和碘的存在形式及物質的量分別為:
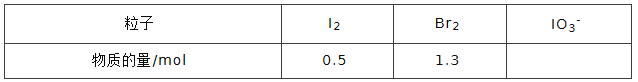
則原溶液中NaI的物質的量為_________mol.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com