
【題目】已知25 ℃時,CaSO4在水中的沉淀溶解平衡曲線如圖所示,該條件下向100 mL的CaSO4飽和溶液中,加入400 mL 0.01 mol·L-1的Na2SO4溶液,針對此過程的下列敘述正確的是(忽略混合過程中的體積變化)
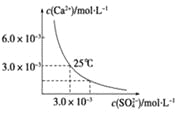
A. 溶液中析出CaSO4沉淀,最終溶液中c(SO42-)較原來大
B. 溶液中無沉淀析出,溶液中c(Ca2+)、c(SO42-)都變小
C. 溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO 42-)都變小
D. 溶液中無沉淀析出,但最終溶液中c(SO42-)較原來大
【答案】D
【解析】試題分析:由圖示可知,在該條件下,CaSO4飽和溶液中,c(Ca2+)=c(SO42-)=3.0×10-3mol/L,Ksp(CaSO4)=9.0×10-6。當向100 mL該條件下的CaSO4飽和溶液中加入200 mL 0.03mol/L的Na2SO4溶液后,混合液中c(Ca2+)=![]() ,c(SO42-)=
,c(SO42-)=![]() ,溶液中c(Ca2+)c( SO42-)=2.1×10-5>Ksp(CaSO4)=9.0×10-6,所以混合液中有沉淀析出,最終溶液中硫酸根離子濃度增大;答案選A。
,溶液中c(Ca2+)c( SO42-)=2.1×10-5>Ksp(CaSO4)=9.0×10-6,所以混合液中有沉淀析出,最終溶液中硫酸根離子濃度增大;答案選A。
【名師點晴】解題關鍵是計算混合溶液中鈣離子濃度和硫酸根離子濃度。另外需要注意該類試題的圖像分析:①曲線上的任意一點,都代表指定溫度下的飽和溶液,由對應的離子濃度可求Ksp。②可通過比較、觀察得出溶液是否達到飽和狀態,是否有沉淀析出。處于曲線上方的點表明溶液處于過飽和狀態,一定會有沉淀析出,處于曲線下方的點,則表明溶液處于未飽和狀態,不會有沉淀析出。③從圖像中找到數據,根據Ksp公式計算得出Ksp的值。④比較溶液的Qc與Ksp的大小,判斷溶液中有無沉淀析出。⑤涉及Qc的計算時,所代入的離子濃度一定是混合溶液中的離子濃度,因此計算離子濃度時,所代入的溶液體積也必須是混合液的體積。


科目:高中化學 來源: 題型:
【題目】在容積不變的密閉容器中進行反應:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各圖表示當其他條件不變時,改變某一條件對上述反應的影響,其中分析正確的是( )
2SO3(g) ΔH<0。下列各圖表示當其他條件不變時,改變某一條件對上述反應的影響,其中分析正確的是( )

A. 圖Ⅰ表示溫度對化學平衡的影響,且甲的溫度較高
B. 圖Ⅱ表示t0時刻使用催化劑對反應速率的影響
C. 圖Ⅲ表示t0時刻增大O2的濃度對反應速率的影響
D. 圖Ⅳ中a、b、c三點中只有b點已經達到化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于某有機物 的性質敘述正確的是( )。
的性質敘述正確的是( )。
A.1 mol該有機物可以與3 mol Na發生反應
B.1 mol該有機物可以與3 mol NaOH發生反應
C.1 mol該有機物可以與6 mol H2發生加成反應
D.1 mol該有機物分別與足量Na或NaHCO3反應,產生的氣體在相同條件下體積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬酸鈉晶體( Na2MoO4·2H2O)是一種無公害型冷卻水系統的金屬緩蝕劑。工業上利用鉬精礦(主要成分是不溶于水的MoS2)制備鉬酸鈉的兩種途徑如圖所示:

(1) NaClO的電子式是
(2) 寫出焙燒時生成MoO3的化學方程式為
(3)途徑I堿浸時發生反應的化學反應方程式為
(4)途徑Ⅱ氧化時發生反應的離子方程式為
(5)分析純的鉬酸鈉常用鉬酸銨[(NH4)2MoO4]和氫氧化鈉反應來制取,若將該反應產生的氣體與途徑I所產生的尾氣一起通入水中,得到正鹽的化學式是
(6)鉬酸鈉和月桂酰肌氨酸的混合液常作為碳素鋼的緩蝕劑。常溫下,碳素鋼在三種不同介質中的腐蝕速率實驗結果如下圖:

①要使碳素鋼的緩蝕效果最優,鉬酸鈉和月桂酰肌氨酸的濃度比應為 。
②當硫酸的濃度大于90%時,腐蝕速率幾乎為零,原因是 。
③試分析隨著鹽酸和硫酸濃度的增大,碳素鋼在兩者中腐蝕速率產生明顯差異的主要原因是 。
(7)鋰和二硫化鉬形成的二次電池的總反應為:xLi + nMoS2![]() Lix(MoS2)n。則電池放電時的正極反應式是: 。
Lix(MoS2)n。則電池放電時的正極反應式是: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某優質甜櫻桃中含有一種羥基酸(用M表示),M的碳鏈結構無支鏈,分子式為C4H6O5;1.34 g M與足量的碳酸氫鈉溶液反應,生成標準狀況下的氣體0.448 L。M在一定條件下可發生如下轉化:M![]() A
A![]() B
B![]() C(M、A、B、C分子中碳原子數目相同)。下列有關說法中不正確的是( )
C(M、A、B、C分子中碳原子數目相同)。下列有關說法中不正確的是( )
A. M的結構簡式為HOOC—CHOH—CH2—COOH
B. B的分子式為C4H4O4Br2
C. 與M的官能團種類、數量完全相同的同分異構體還有1種
D. C物質不可能溶于水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用鋅片、銅片、發光二極管、濾紙、導線等在玻璃片制成如圖所示的原電池,當濾紙用醋酸溶液潤濕時,二極管發光。下列有關該電池的說法正確的是( )

A.銅片上的電極反應:Cu2++2e﹣=Cu
B.電子通過溶液由鋅片流向銅片
C.電池工作時電能直接轉化為化學能
D.該電池工作時,若有16.25gZn被溶解,導線中轉移0.50mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過渡元素鐵可形成多種配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
(1)Fe2+基態核外電子排布式為 。
(2)科學研究表明用TiO2作光催化劑可將廢水中CN-轉化為OCN-、并最終氧化為N2、
CO2。OCN-中三種元素的電負性由大到小的順序為 。
(3)與CN-互為等電子體的一種離子為 (填化學式);1mol [Fe(CN)6]4-中含有σ鍵的數目為 。
(4)鐵的另一種配合物Fe(CO)5熔點為﹣20.5℃,沸點為103℃,易溶于CCl4,據此可以判斷Fe(CO)5晶體屬于 (填晶體類型)。
(5)鐵鋁合金的一種晶體屬于面心立方結構,其晶胞可看成由8個小體心立方結構堆砌而成.已知小立方體如圖所示.該合金的化學式為 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上曾經通過反應“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生產金屬鈉。下列有關說法正確的是( )
Fe3O4+2H2↑+4Na↑”生產金屬鈉。下列有關說法正確的是( )
A.用磁鐵可以將Fe與Fe3O4分離
B.將生成的氣體在空氣中冷卻可獲得鈉
C.該反應條件下鐵的氧化性比鈉強
D.每生成1molH2,轉移的電子數約為4×6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 A、B、C、D、E、F均為短周期主族元素,且原子序數依次增大,A是原子半徑最小的元素,B的最高價氧化物的水化物可與其氫化物反應形成離子化合物甲;A與D可以按照原子個數比4:1形成化合物乙,且乙分子中含有18個電子,E與B同主族,C的陽離子與F的陰離子相差一個電子層,且可形成陽離子、陰離子個數比為2:1的離子化合物丙.
(1)B的氣態氫化物的電子式為_____________,請用電子式表示A與C形成化合物的過程____________。
(2)E在周期表中的位置為______________________。
(3)下列說法正確的有_________。
①化合物乙分子中只含有極性共價鍵
②化合物甲和化合物丙都含有離子鍵和共價鍵
③B、E分別與A形成的簡單化合物中,B的更穩定
④C、D、E、F原子半徑由大到小的順序為C>D>E>F
(4)寫出由以上元素構成的10電子分子與18電子分子按物質的量之比1:1反應生成鹽的化學方程式_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com