
【題目】50mL 0.50molL﹣1鹽酸與50mL 0.55molL﹣1 NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.
試回答下列問題: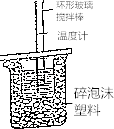
(1)大小燒杯間填滿碎紙條的作用是;
(2)大燒杯上如不蓋硬紙板,求得的中和熱數值將(填“偏大”、“偏小”或“無影響”),結合日常生活的實際該實驗在進行效果更好;
(3)實驗中改用60mL 0.50molL﹣1鹽酸與50mL 0.55molL﹣1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量(填“相等”、“不相等”),簡述理由:;
(4)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會;用50mL 0.5mo1L﹣1NaOH溶液進行上述實驗,測得的中和熱的數值會(填“偏大”、“偏小”或“無影響”)
【答案】
(1)減少實驗過程中的熱量損失
(2)偏小;保溫杯
(3)不相等;反應放出的熱量和所用酸以及堿的量的多少有關
(4)偏小;無影響”
【解析】解:(1)中和熱測定實驗成敗的關鍵是保溫工作,大小燒杯之間填滿碎紙條的作用是減少實驗過程中的熱量損失,所以答案是:減少實驗過程中的熱量損失;(2)大燒杯上如不蓋硬紙板,會使一部分熱量散失,求得的中和熱數值將會減小;在日常生活實際該實驗在保溫杯中效果更好;
所以答案是:偏小;保溫杯; (3)反應放出的熱量和所用酸以及堿的量的多少有關,用60mL 0.50molL﹣1鹽酸與50mL 0.55molL﹣1 NaOH溶液進行反應,與上述實驗相比,生成水的量增多,所放出的熱量偏高,但是中和熱的均是強酸和強堿反應生成1mol水時放出的熱,與酸堿的用量無關,中和熱數值相等,
所以答案是:不相等;反應放出的熱量和所用酸以及堿的量的多少有關;(4)氨水為弱堿,電離過程為吸熱過程,所以用氨水代替稀氫氧化鈉溶液反應,反應放出的熱量偏小,中和熱的數值會偏小;
中和熱是強酸和強堿反應生成1mol水時放出的熱量,與酸堿的用量無關,所以用5mL 0.50mol/L NaOH溶液進行上述實驗,測得的中和熱的數值無影響;
所以答案是:偏小;無影響.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】工業上用鋁土礦(主要成分為Al2O3,含Fe2O3雜質)為原料冶煉鋁的工藝流程如下:

下列敘述正確的是
A. 試劑X可以是氫氧化鈉溶液,也可以是鹽酸
B. 反應①、過濾后所得沉淀為氫氧化鐵
C. 圖中所示轉化反應都不是氧化還原反應
D. 反應②的化學方程式為NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋中蘊含著豐富的資源。利用海水提取淡水、溴和鎂的部分過程如圖所示。

(1)海水淡化的方法有_________________、離子交換法和電滲析法等。
(2)用純堿吸收濃縮海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2時,轉移的電子是_________________mol。
(3)海水中部分離子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物質的量濃度是____________mol/L。若從100 L的海水中提取鎂,理論上加入沉淀劑Ca(OH)2的質量是_______________g。
(4)由Mg(OH)2得到單質Mg,以下方法最合適的是________________(填序號)。
A. Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() 無水MgCl2
無水MgCl2![]() Mg
Mg
D. Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在檢驗用FeCl3溶液生產銅制印刷線路板后所得的廢液成分的實驗中,下列根據實驗現象得出的結論不正確的是
A. 若用惰性電極電解該廢液,陰極沒有立即產生紅色物質,說明廢液中不含Cu2+
B. 若向廢液中滴加硝酸酸化的AgNO3溶液,產生白色沉淀,說明廢液中含有C1-
C. 若向廢液中加少量鐵粉,充分反應后無固體剩余,說明廢液中含有Fe3+
D. 若向廢液中滴加KSCN 溶液,無現象,再加入氯水后溶液呈血紅色,說明廢液中含有Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. Na保存在煤油中;溴保存在棕色試劑瓶,并用水封
B. MgO可作耐高溫材料
C. Na2CO3常用來治療人體胃酸過多
D. K-Na合金可作核反應堆的導熱劑;Mg-Al合金可用于制造飛機部件
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在80℃時,將0.40mol的N204氣體充入2L已經抽空的固定容積的密閉容器中,發生如下反應:N2O42NO2 , 隔一段時間對該容器內的物質進行分析,得到如下數據:
時間(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)計算20s一40s內用N2O4表示的平均反應速率為molL﹣1S﹣1;
(2)計算在80℃時該反應的平衡常數K=(請注明單位).
(3)反應進行至100s后將反應混合物的溫度降低,混合氣體的顏色(填“變淺”.“變深”或“不變”)
(4)要增大該反應的K值,可采取的措施有(填序號):
A.增大N2O4的起始濃度
B.向混合氣體中通入NO2
C.使用高效催化劑
D.升高溫度
(5)如圖是80℃時容器中N2O4物質的量的變化曲線,請在該圖中補畫出該反應在60℃時N2O4物質的量的變化曲線. 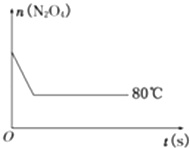
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗過程中的現象及結論均正確的是

A. 錐形瓶中有氣體產生,燒杯中液體變渾濁,證明非金屬性:Cl>C>Si
B. 形成美麗的紅色噴泉,證明HC1極易溶于水
C. 配制一定物質的量濃度的NaOH溶液時,定容時如圖觀察使配制的NaOH 溶液濃度偏低
D. 只產生紅褐色沉定,證明Ksp[Al(OH3)]>Ksp[Fe(OH)3]
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com