
【題目】用NA表示阿伏加德羅常數的值。下列敘述不正確的是:
A. 2.7 g 金屬鋁分別與足量的NaOH溶液和鹽酸反應轉移的電子數目均為0.3NA
B. 標準狀況下,2.24 L Cl2與過量NaOH溶液反應,轉移的電子總數為0.1 NA
C. 1L 1 molL-1 Na2CO3溶液中陰離子數小于NA
D. 2.3 g金屬鈉完全反應生成Na2O與Na2O2的混合物中陰離子數為0.05 NA
【答案】C
【解析】
A、2.7g鋁的物質的量為0.1mol,而無論與鹽酸還是氫氧化鈉溶液反應后鋁元素均變為+3價,故1mol鋁均失去3mol電子,即0.3NA個,故A正確;B. 標準狀況下,2.24LCl2的物質的量為![]() =0.1mol,由方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,反應中氯元素化合價由0價升高為+1價,由0價降低為-1價,氯氣起氧化劑與還原劑作用,各占一半,轉移電子數目為0.1mol×
=0.1mol,由方程式Cl2+2NaOH=NaCl+NaClO+H2O可知,反應中氯元素化合價由0價升高為+1價,由0價降低為-1價,氯氣起氧化劑與還原劑作用,各占一半,轉移電子數目為0.1mol×![]() ×2×NAmol-1=0.1NA,故B正確;C、Na2CO3溶液中碳酸根離子水解生成碳酸氫根離子和氫氧根離子,陰離子總數增多,1L 1 molL-1 Na2CO3溶液中陰離子數大于NA,故C錯誤;D、2.3g鈉的物質的量為0.1mol,而反應后生成的鈉的化合物氧化鈉或過氧化鈉中,均是2個鈉離子對應一個陰離子,故0.1mol鈉離子對應0.05mol陰離子即0.05NA個,故D正確;故選C。
×2×NAmol-1=0.1NA,故B正確;C、Na2CO3溶液中碳酸根離子水解生成碳酸氫根離子和氫氧根離子,陰離子總數增多,1L 1 molL-1 Na2CO3溶液中陰離子數大于NA,故C錯誤;D、2.3g鈉的物質的量為0.1mol,而反應后生成的鈉的化合物氧化鈉或過氧化鈉中,均是2個鈉離子對應一個陰離子,故0.1mol鈉離子對應0.05mol陰離子即0.05NA個,故D正確;故選C。


科目:高中化學 來源: 題型:
【題目】過氧化鈉是一種淡黃色固體,它能與二氧化碳反應生成氧氣,在潛水艇中用作制氧劑,供人類呼吸之用。它與二氧化碳反應的化學方程式為:2Na2O2+2CO2=2Na2CO3+O2。某學生為了驗證這一實驗,以足量的大理石、足量的鹽酸和1.95g過氧化鈉樣品為原料,制取O2,設計出如下實驗裝置:
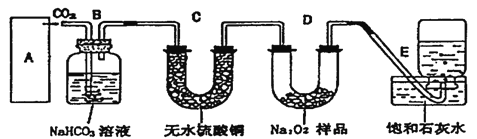
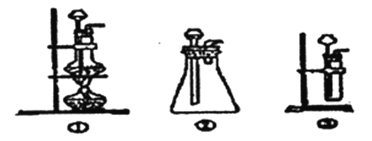
(l)A中制取CO2的裝置,應從下列圖①、②、③中選哪個圖:_____。
B裝置的作用是________, C裝置內可能出現的現象是________。為了檢驗E中收集到的氣體,在取出集氣瓶后,用________的木條伸入集氣瓶內,木條會出現________。
(2)若E中的石灰水出現輕微白色渾濁,請說明原因:________。
(3)若D中的1.95g過氧化鈉樣品接近反應完畢時,你預測E裝置內有何現象?________。
(4)反應完畢時,若測得E中的集氣瓶收集到的氣體為250mL,又知氧氣的密度為1.43g/L,當裝置的氣密性良好的情況下,實際收集到的氧氣體積比理論計算值______(答大或小),相差約________mL(取整數值,所用數據均在標準狀況下測定),這是由于________。
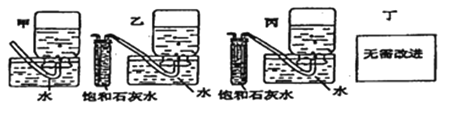
(5)你認為上述A~E的實驗裝置中,E部分是否安全、合理?E是否需要改為下列四項中的哪一項:________。(用甲、乙、丙、丁回答)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列變化過程中,原物質內僅有共價鍵被破壞,同時有離子鍵形成的是( )
A. 鹽酸和NaOH溶液反應
B. 氯化氫溶于水
C. 稀硫酸與BaCl2溶液反應
D. 氯化氫與氨氣反應生成NH4Cl固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化工廠為了綜合利用生產過程中的副產品CaSO4,與相鄰的合成氨廠聯合設計了以下制備(NH4)22SO4的工藝流程:
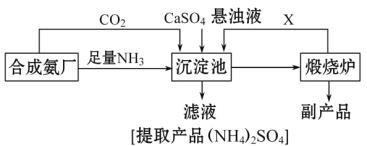
請回答以下問題:
(1)工業合成氨反應的條件是_____________________。沉淀池中發生的主要反應方程式是________________________。該反應能夠發生的原因是__________________________。
(2)提純濾液以獲得(NH4)2SO4晶體,必要的操作步驟是:__________(填序號)。
A.萃取 B.蒸發濃縮 C.冷卻結晶 D.蒸餾
(3)上述生產流程中,有關NH3的作用及說明正確的是:__________(填序號)。
A.提供制備所需的氮元素
B.增大CO32-的濃度促進反應發生
C.作反應的催化劑
D.生產1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)該生產過程中的副產品是_______________,從綠色化學和資源綜合利用的角度說明上述流程的主要優點是______________.缺點是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法中正確的是
A. 16g CH4含有的原子數為NA
B. 17 g OH- 含有的質子數為9NA
C. 2g D2氣體中含有的中子數為0.5 NA
D. 標準狀況下22.4 L NH3含有的電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型乙醇電池用磺酸類質子作溶劑,比甲醇電池效率高出32倍。電池總反應為:C2H5OH +3O2= 2CO2 +3H2O,電池示意圖如下圖。下面對這種電池的說法正確的是:
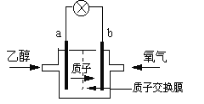
A. 標準狀況下,通入5.6LO2并完全反應后,有0.5mol電子轉移
B. 電池工作時電子由b極沿導線經燈泡再到a極
C. 電池正極的電極反應為:4H+ +O2 +4e- =2H2O
D. b極為電池的負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的短周期部分,表中字母分別表示一種元素。

請回答下列問題:
(1)由表中兩種元素的原子按1∶1組成的常見液態化合物的稀溶液易被催化分解,可使用的催化劑為(填序號)____。
a.MnO2 b.NaCl c.Na2SO3 d.KMnO4
(2)d、e、h四種元素最高價氧化物對應的水化物的酸性由弱到強的順序為(用化學式表示)________。b、c、f、g、h形成的簡單離子的半徑由小到大的順序為_______(用離子符號填寫)。
(3)在1L的密閉容器中,通入1molf2氣體和3mola2氣體,一定溫度下反應生成fa3氣體,2min時,測得f2的濃度為0.75mol·L-1,則2min時fa3的物質的量為_____mol;反應達到平衡狀態時,若增大fa3的產率,可以采取措施(填序號)_____。
①升高溫度 ②恒容充入氦氣
③向密閉容器內充入f2氣 ④及時分離出fa3氣體
(4)d與a可形成化合物d5a12,試寫出它的一氯取代物有一種的同分異構體的結構簡式_____。
(5)a、d兩種元素可形成多種化合物,其中化合物X的產量是衡量一個國家石油化工發展水平的標志。X可與H2O在一定條件下反應生成化合物乙醇,該反應的化學方程式為:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水泥是重要的建筑材料。水泥熟料的主要成分為CaO、SiO2,并含有一定量的鐵、鋁和鎂等金屬的氧化物。實驗室測定水泥樣品中鈣含量的過程如圖所示:

回答下列問題:
(1)在分解水泥樣品過程中,以鹽酸為溶劑,氯化銨為助溶劑,還需加入幾滴硝酸。加入硝酸的目的是__________,還可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于強酸但可與一種弱酸反應,該反應的化學方程式為____________________________________。
(3)加氨水過程中加熱的目的是___________。沉淀B的主要成分為_____________、____________(填化學式)。
(4)草酸鈣沉淀經稀H2SO4處理后,用KMnO4標準溶液滴定,通過測定草酸的量可間接獲知鈣的含量,滴定反應為: ![]() +H++H2C2O4→Mn2++CO2+H2O。實驗中稱取0.400 g水泥樣品,滴定時消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,則該水泥樣品中鈣的質量分數為______________。
+H++H2C2O4→Mn2++CO2+H2O。實驗中稱取0.400 g水泥樣品,滴定時消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,則該水泥樣品中鈣的質量分數為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從煤和石油中可以提煉出化工原料A和B,A是一種果實催熟劑,它的產量用來衡量一個國家的石油化工發展水平.B是一種比水輕的油狀液體,B僅由碳氫兩種元素組成,碳元素與氫元素的質量比為12:1,B的相對分子質量為78.回答下列問題:
(1)A的電子式 ______________ ,A的結構簡式 _______________ .
(2)與A相鄰的同系物C使溴的四氯化碳溶液褪色的化學反應方程式 ______________________,反應類型_______________。
(3)在碘水中加入B振蕩靜置后的現象_________________________
(4)B與濃H2SO4與濃HNO3在50-60℃反應的化學反應方程式 ________________________,反應類型______________________。
(5)等質量的A、B完全燃燒時消耗O2的物質的量______(填“A>B”或“A<B”或“A=B”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com